物化性質
三氟化鈷(化學式:CoF
3),室溫下為不穩定的淺棕色易
潮解固體,密度為3.88g/mL(25℃),溶於水放出氧氣,是很常用的
氟化劑。在CO
2氣流中加熱到250℃時,開始放出F
2,在350℃時,則完全轉變為CoF
2。
三氟化鈷可以與許多金屬或非金屬單質反應生成相應的
氟化物,自身被還原為二氟化鈷。三氟化鈷也有
水合物,CoF
3·3.5H
2O,但結構尚不清楚。
用三氟化鈷氟化
有機化合物時,首先用二氟化鈷與氟氣在300℃左右反應生成三氟化鈷,然後引入有機反應物與三氟化鈷反應。三氟化鈷被還原後生成的二氟化鈷可以循環使用。氟化反應包含單電子轉移及
碳正離子中間體機理:
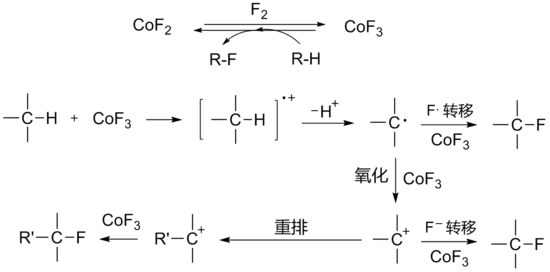 氟化反應原理
氟化反應原理該反應通常用於全氟有機物的製取。三氟化鈷的氧化性較強,一般反應都在氣相、無
溶劑或以無水
氟化氫作介質中進行,常伴有
重排或其他副反應的發生,用相關的KCoF
4氟化可使反應的選擇性增強。400℃左右時所有
碳氫化合物的C-H鍵都可被轉化為C-F鍵,並且氟也可以加到不飽和鍵上。
2CoF3+ R-H → CoF2+ R-F + HF
製取
氯化鈷(II)或氟化鈷(II)與
氟氣在250°C時發生快速放熱反應生成三氟化鈷固體:
2CoCl2+ 3F2→ 2CoF3+ 2Cl2
具體實驗步驟如下:
將盛有CoF
2的石英舟放入石英反應管中,從反應管的一端通入F
2,反應開始進行得很慢,當將反應管加熱至75℃左右時,由於反應放熱,反應就猛烈起來,溫度慢慢升至200℃,產物在F
2氣流中冷卻;最後用
氮氣流驅除多餘的F
2。氟化反應與在前面相同的裝置中進行,
石英舟中為無水CoCl
2或Co
2O
3,將反應管從室溫開始漸漸升溫至300℃,保持此溫度直至反應管的末端有F
2放出為止,然後用乾燥的氮氣將裝置中多餘的F
2驅除出去。
用途
CoF
3可與水發生反應,是非常強的氟化劑和氧化劑,被廣泛用作氟化劑。用於有機氟化合物(尤其是全氟化合物)的製取,還原產物是二氟化鈷。類似可以用作氟化試劑的金屬氟化物還有
三氟化錳、
二氟化銀等。
儲運運輸
庫房低溫,通風,乾燥;密閉保存,防潮。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:3
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:4
 氟化反應原理
氟化反應原理
