《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》是常州製藥廠有限公司於2008年5月27日申請的專利,該專利的申請號為2008101107091,公布號為CN101591301,授權公布日為2009年12月2日,發明人是陳本順、王兵、鄒林。
《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》對一種3,5-二羥基庚-6-烯酸衍生物製備方法進行了改進。中間體3-羥基-5-氧代-6-庚烯酸酯衍生物經不對稱還原,得到的3,5-二羥基庚-6-烯酸酯衍生物粗品鹼性水解得到3,5-二羥基庚-6-烯酸鈉鹽衍生物,經萃取純化得到3,5-二羥基庚-6-烯酸鈉鹽衍生物溶液,然後將3,5-二羥基庚-6-烯酸鈉鹽衍生物轉化為3,5-二羥基庚-6-烯酸衍生物,將3,5-二羥基庚-6-烯酸酸衍生物再次高產率轉化為3,5-二羥基庚-6-烯酸酯衍生物,通過重結晶等純化手段得到純的3,5-二羥基庚-6-烯酸酯衍生物。將純的3,5-二羥基庚-6-烯酸酯衍生物再水解成3,5-二羥基庚-6-烯酸鈉鹽衍生物,最後轉化為3,5-二羥基庚-6-烯酸鈣鹽衍生物。得到了高質量的3,5-二羥基庚-6-烯酸鈣衍生物。
2013年,《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》獲得第八屆江蘇省專利項目獎優秀獎。
基本介紹
- 中文名:一種3,5-二羥基庚-6-烯酸衍生物的製備方法
- 公布號:CN101591301
- 公布日:2009年12月2日
- 申請號:2008101107091
- 申請日:2008年5月27日
- 申請人:常州製藥廠有限公司
- 地址:江蘇省常州市勞動東路518號
- 發明人:陳本順、王兵、鄒林
- Int.Cl.:C07D239/42(2006.01)I、A61P9/12(2006.01)I、A61P9/10(2006.01)I
- 代理機構:北京萬科園智慧財產權代理有限責任公司
- 代理人:張亞軍、師瑄
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,附圖說明,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
他汀(statins)是2008年5月前可供用於減低患心血管疾病危險的患者血流中低密度脂蛋白(LDL)顆粒濃度的最有效的治療藥物。因此,他汀被用於治療高膽固醇血症,高脂蛋白血症和動脈粥樣硬化症。血流中的高水平LDL與阻塞血流的冠狀動脈病變的形成相關,並且能夠使血檢破裂和促進血檢形成。Goodman和Gilman,The Pharmacological Basis of Therapeutics,第879頁(1996年第9版)。
他汀類通過競爭性抑制3-羥基-3-甲基-戊二醯輔酶A(“HMG-CoA”)還原酶來抑制人體中膽固醇的生物合成。HMG-CoA還原酶催化HMG轉化為甲羥戊酸類物質,其是膽固醇生物合成中的限速步驟。膽固醇的形成減少引起了LDL受體數目的增加和LDL顆粒在血流中的濃度的相應減低。血流中的LDL水平的減低降低了冠狀動脈疾病的危險。J.A.M.A.1984,251,351-74。
2008年5月前可獲得的他汀類包括洛伐他汀,辛伐他汀,普伐他汀,氟伐他汀,西立伐他汀和阿托伐他汀。洛伐他汀(公開在專利US4231938)和辛伐他汀(公開在專利US4444784)以內酯形式給藥。在吸收後,內酯環在肝內通過化學和酶促水解被打開,產生了活性羥基酸。普伐他汀(公開在專利US4346227中)以鈉鹽形式給藥。氟伐他汀(公開在專利US4739073中)和西立伐他汀(公開在專利US5006530和US5177080中)也以鈉鹽形式給藥,是完全合成化合物,在結構上部分不同於含有六氫萘環的這類真菌衍生物。
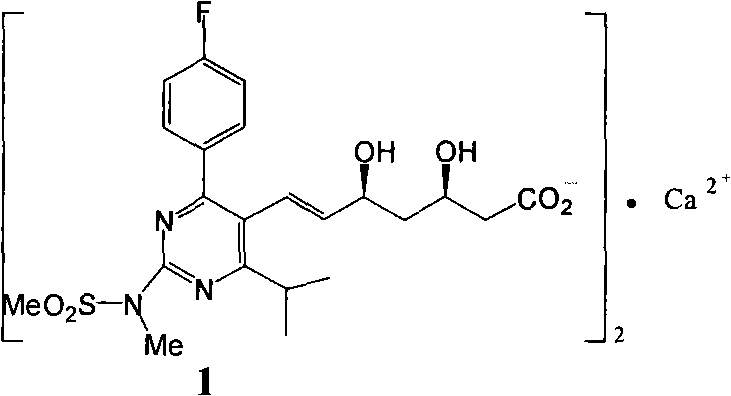
阿托伐他汀和兩種新的“超級他汀”瑞舒伐他汀和匹伐他汀以鈣鹽形式給藥。瑞舒伐他汀鈣(E)-7-[4-(4-氟苯基)-6-異丙基]-2-[甲基(甲磺醯基)氨基]嘧啶-5-基(3R,5S)-3,5-二羥庚-6-烯酸鈣鹽是HMG-CoA還原酶抑制劑,由Shionogi開發,用於每日一次口服治療高脂血症(Ann Rep,Shionogi,1996;Direct communications,Shionogi,1999年2月8日和2000年2月25日)。瑞舒伐他汀鈣是所謂的超級他汀,與第一代藥物相比,它能夠更有效地降低LDL-膽固醇和甘油三酯。瑞舒伐他汀鈣具有以下化學式:
瑞舒伐他汀以CRESTOR的名稱市售,用於治療哺乳動物例如人。根據CRESTOR的製造商,它以每日大約5毫克到大約40毫克的日劑量給藥。對於需要要求不高的LDL-C減低或具有肌病誘病因素的患者來說,推薦5毫克劑量,而對於普通病人,推薦10毫克劑量,對於具有顯著的高膽固醇血症和要求高的脂質目標(>190毫克/dL)的患者,推薦20毫克劑量,以及對於較低劑量沒有反應的患者來說,推薦40毫克劑量。
瑞舒伐他汀鈣的合成首先由SHIONOGI&CO(JP)公開於歐洲專利EP0521471(優先權日:1991年7月1日)。《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》的工藝流程如下:
該專利公開和要求保護瑞舒伐他汀、它的鈣鹽(2:1)和它的內酯形式。EP0521471專利的方法通過讓4-(4-氟苯基)-6-異丙基-2-(N-甲基-N-甲基磺醯基氨基)-5-嘧啶甲醛(pyrimidinecarbardehyde)與(3R)-3-(叔丁基二甲基甲矽烷氧基)-5-氧代-6-三苯基正磷叉基己酸甲酯在乙睛中在回流下反應來製備瑞舒伐他汀。矽烷基然後用氟化氫裂解,隨後用NaBH4還原,獲得瑞舒伐他汀的甲酯。該酯然後在乙醇中在室溫用氫氧化鈉水解,隨後除去乙醇,添加醚,獲得瑞舒伐他汀的鈉鹽。鈉鹽然後用多步方法轉化為鈣鹽。將鈉鹽溶於水中,保持在氮氣氛圍下。然後將氯化鈣加入到溶液中,導致瑞舒伐他汀鈣(2:1)沉澱。
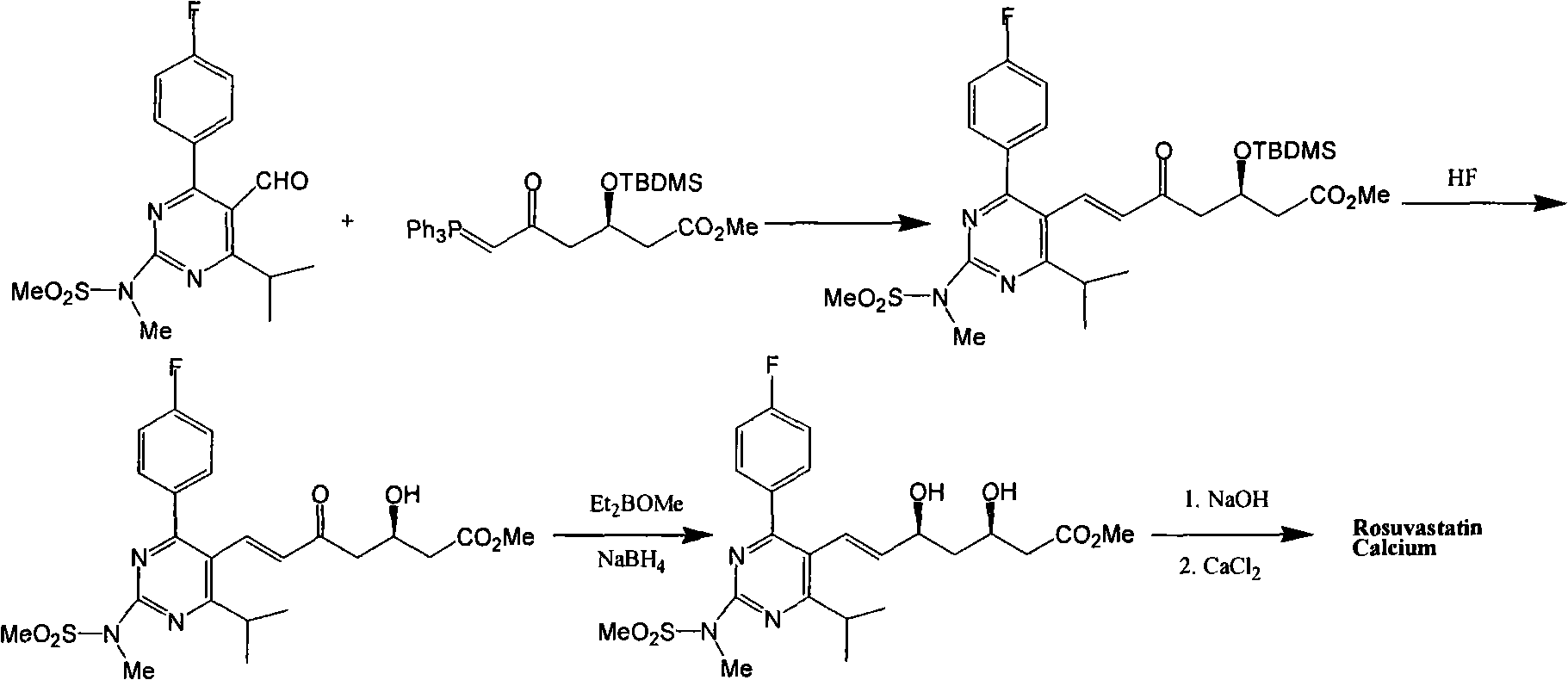
Shionogi實驗室發表在Bioorganic&Medicinal Chemistry,Vol.5,NO.2,pp437-444,1997同樣報導了瑞舒伐他汀鈣的合成方法,該文獻與專利EP0521471合成瑞舒伐他汀鈣的方法一致。
ASTRAZENECA UK LTD(GB)專利WO0042024(優先權日:1999年1月9日)報導了晶型瑞舒伐他汀鈣。
ASTRAZENECA UK LTD(GB),SHIONOGI&CO(JP)等共同申請的專利WO0049014(優先權日:1999年2月17日)同樣闡述了瑞舒伐他汀鈣的合成。其合成路線如下:
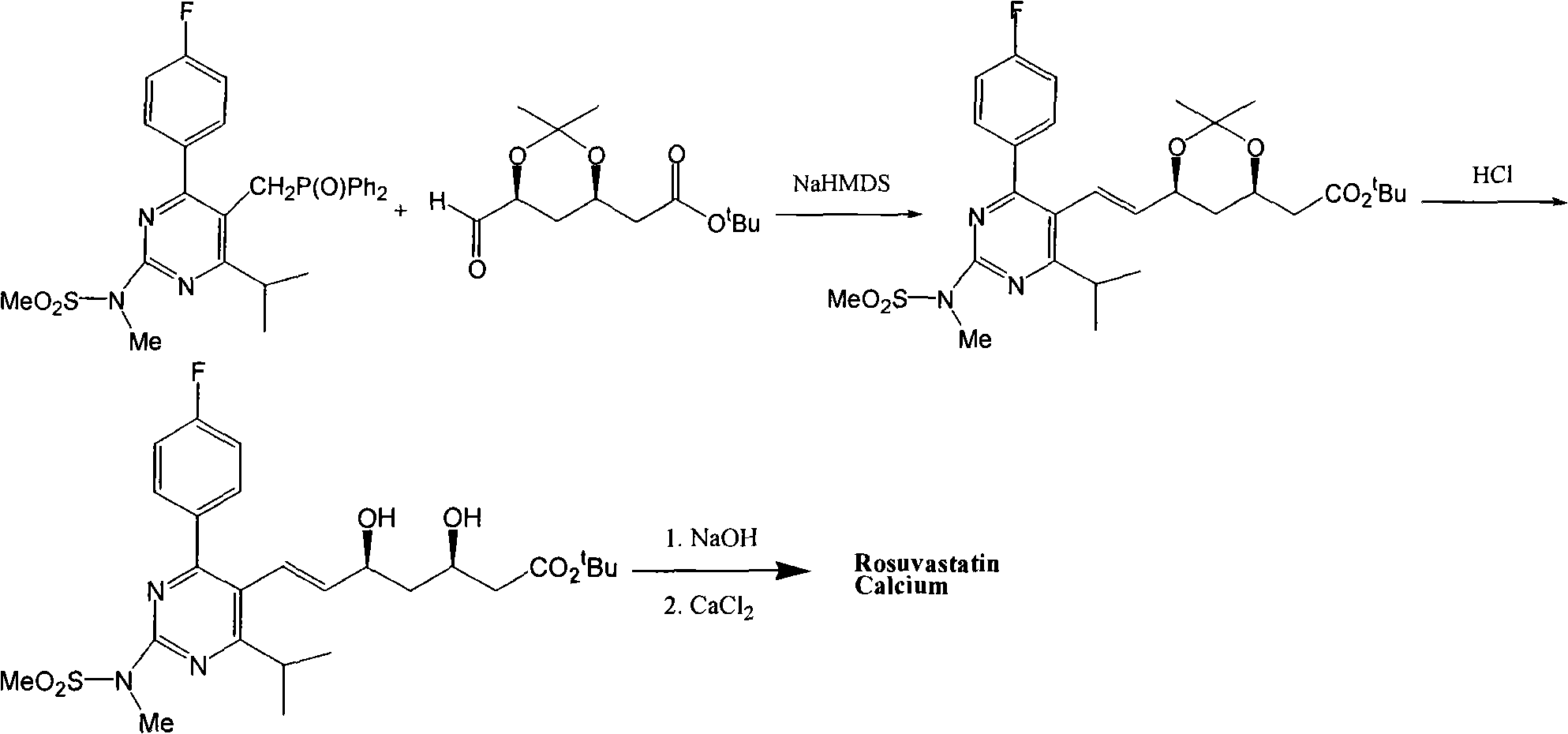
該專利路線合成方法與化合物專利存在較大差別,該路線採用了含兩個手性中心的2-[(4R,6S)-6-甲醯基-2,2-二甲基-1,3-二氧雜環己烷-4-基]乙酸叔丁酯作為側鏈,與主鏈磷葉立德試劑二苯基[[4-(4-氟苯基)-6-異丙基-2-[甲基(甲磺醯基)氨基]嘧啶]-5-基]甲基]氧化磷發生Wittig縮合,然後酸性水解脫丙酮叉保護,鹼性水解皂化,最後將鈉鹽轉化為鈣鹽。
Lonza AG申請了EP1035127專利(優先權日:1999年3月10日),描述了合成瑞舒伐他汀鈣的中間體的製備方法,該中間體可以用於WO0049014提供的合成路線。
ASTRAZENECA AB(SE)專利WO0154668和WO0154669(優先權日:2000年1月26日)報導瑞舒伐他汀鈣組合物。該藥物組合物含有瑞舒伐他汀或它的鹽和多價三鹼式磷酸鹽。ASTRAZENECAAB(SE)申請的WO0160804(優先權日:2000年2月15日)報導了瑞舒伐他汀結晶鹽,這些結晶鹽可以用於純化瑞舒伐他汀鈣。ASTRAZENECA AB(SE)專利WO0241895(優先權日:2000年11月22日)公開了治療雜合家族性高血脂症。
CLS LABORATORIES,INC.申請了WO03087112(優先權日:2002年4月9日)報導了磷葉立德試劑的改進,通過生物酶法戊二酸二酯為戊二酸單酯,然後轉化成矽烷保護的叔丁酯,得到與EP0521471酯基不一樣的磷葉立德試劑。該專利後續反應與EP0521471基本一致。
RANBAXY LAB LTD(IN)申請WO03097614(優先權日:2002年5月21日)描述了主鏈醛描述了主鏈醛N-[4-(4-氟苯基)-5-甲醛基-6-(1-甲基乙基)-2-嘧啶基]-N-甲基-甲烷磺醯胺的合成工藝改進,成品的合成方法與EP0521471基本一致。
ASTRAZENECA UK LTD(GB)專利WO2004014872(優先權日:2002年8月13日)描述了瑞舒伐他汀鈣成鹽工藝改進,改進工藝條件生成高過濾固體。
ASTRAZENECA UK LTD(GB)專利WO2004108691(優先權日:2003年6月5日)描述了瑞舒伐他汀鈣成鹽工藝改進。該改進主要基於專利WO0049014描述的瑞舒伐他汀鈣的製備方法。
CIBA SPECIALTY CHEMICALS HOLDING INC.專利WO2004/103977(優先權日:2003年5月21日)描述了瑞舒伐他汀鈣嘧啶雜環中間體合成方法的改進。
TEVA PHARMA(IL)申請的專利WO2005023778(優先權日:2003年8月28日)報導了工業化規模製備基本上不含雜質的瑞舒伐他汀鈣的方法,瑞舒伐他汀酯的製備方法,仍然套用的專利EP0521471描述的方法,而如何製備高純度瑞舒伐他汀酯沒有報導。
ASTRAZENECA UK LTD(GB)WO2005042522(優先權日:2003年10月24日)描述了基於WO0049014合成方法,分離結晶性中間體製備瑞舒伐他汀。
ZENTIVA A S(CZ)專利WO2005068435(優先權日:2004年01月16日)WO2007/000121(優先權日:2005年6月29日)報導以瑞舒伐他汀內酯為中間體合成瑞舒伐他汀鈣等改進方法。
CIBA SPECIALTY CHEMICALS HOLDING INC.專利WO2006079611(優先權日:2005年1月31日)報導了瑞舒伐他汀鈣的其他晶型(晶型B、C)。
Teva pharmaceutical industries Ltd.WO2006091771(優先權日:2005年2月22日)報導了瑞舒伐他汀鈣的合成工藝改進。該專利路線與專利EP0521471基本一致,主要不同之處在於將側鏈酯基由甲酯替換為叔丁酯,按照該專利方法,製造高純度瑞舒伐他汀仍然非常困難。
信宜製藥廠申請的專利CN1872841(優先權日:2005年6月1日)描述了化合物(5)的重結晶方法,化合物(5)用甲苯乙醚混合溶劑進行重結晶得到純度達與98%以上的中間體,但瑞舒伐他汀甲酯仍然需要柱層析純化,而且純度仍然很低,非對映體含量為0.5%,其他雜質總和1%。
LEK PHARMACEUTICALS D D(SI)專利WO2006136408(優先權日:2005年6月24日)描述了瑞舒伐他汀酯製備瑞舒伐他汀鈣及其他鹽的方法。
Teva pharmaceutical industries Ltd.專利WO2007022488(優先權日:2005年8月16日)報導了瑞舒伐他汀鈣結晶中間體及其製備方法。
隨著瑞舒伐他汀鈣的臨床試驗降脂效果顯著的報導,並於2003年2月19日首次在加拿大上市,瑞舒伐他汀鈣的研究受到廣泛關注,其他工藝路線及工藝改進的報導見專利:CN1687087,CN1733737,CN1733774,CN1763015,CN1807418,CN1958593,LV13268,US20040176401,US20040259946,US20050153407,US20050154213,US20058222415,US20060040898,US20070123550,US20070037979,WO03064382,WO03097614,WO2004011420,WO2004052867,WO2004113314,WO2005092867,WO2006067456,WO2006100689,WO2006106526,WO2006126035,WO2007007119,WO2007017117。
專利EP0521471雖然公開了瑞舒伐他汀鈣的合成方法,申請人按照該專利方法進行合成,得到的瑞舒伐他汀鈣的純度低,總收率低,成本高。《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》是專利EP0521471瑞舒伐他汀鈣合成工藝的改進,EP0521471作為參考引入。瑞舒伐他汀鈣可用於治療高膽固醇血症,高蛋白血症以及動脈硬化症。《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》同樣涉及用於該化學合成方法的結晶中間體。
發明內容
專利目的
基於最早專利EP0521471報導的瑞舒伐他汀合成路線,及其相關2008年5月前已有技術,難以獲得高純度的瑞舒伐他汀鈣,難以實現工業化大規模製造。
EP0521471專利中瑞舒伐他汀甲酯通過柱層析進行純化後仍描述為糖漿狀物,2008年5月前已有技術瑞舒伐他汀甲酯均描述為糖漿狀物,難以重結晶純化,純度一般低於97%,非對映體大於0.5%。專利中在乙醇中水解成鈉鹽,然後用乙醚打漿得到結晶性鈉鹽晶型粉末。濃縮鈉鹽得到粘稠漿狀物,加乙醚打漿成固體粉末在實驗室可以實現,但放大操作非常困難,而且提純效果不理想,通過該操作不能除去非對映體。專利中用鈉鹽直接合成鈣鹽,鈣鹽難以通過重結晶等手段進行純化。直接用EP0521471專利製備的瑞舒伐他汀甲酯用於合成瑞舒伐他汀鈣,產品中的非對映異構體的含量一般為0.8%左右,還有多個大於0.1%的未知雜質。按照該專利進行製備瑞舒伐他汀鈣,難以得到高純度瑞舒伐他汀鈣,難以大規模製造。
該申請人基於專利EP0521471,通過深入研究,發明了一條改進的瑞舒伐他汀鈣的合成方法。其特徵在於最佳化了硼烷不對稱還原,得到了低非對映體含量的瑞舒伐他汀酯粗品,瑞舒伐他汀酯粗品通過水解成水溶性鈉鹽後,用溶劑提取除去不能溶於水的雜質後,再高收率轉化成純度較高的酯,然後通過重結晶手段純化得到純的瑞舒伐他汀酯,最後高收率地轉化為瑞舒伐他汀鈣。
《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》有效解決了基於專利EP0521471路線瑞舒伐他汀鈣的雜質控制及大規模製造問題,解決了通過該路線難以製備符合ICH指南質量要求的原料藥問題。同時提供了不合格瑞舒伐他汀酯、酸、內酯、鹽的再加工工藝。
該發明解決了如何製備高純度瑞舒伐他汀鈣問題,尤其是製備含有低非對映體純度的瑞舒伐他汀鈣問題。
技術方案
具體而言,《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》所涵蓋的範圍包括如下權利要求:
1、一種製備式(1)所示的分子的方法,其包括:
a)式(2)所示的分子在二烷基甲氧基硼絡合下氫負子轉移不對稱還原生成式(3)。
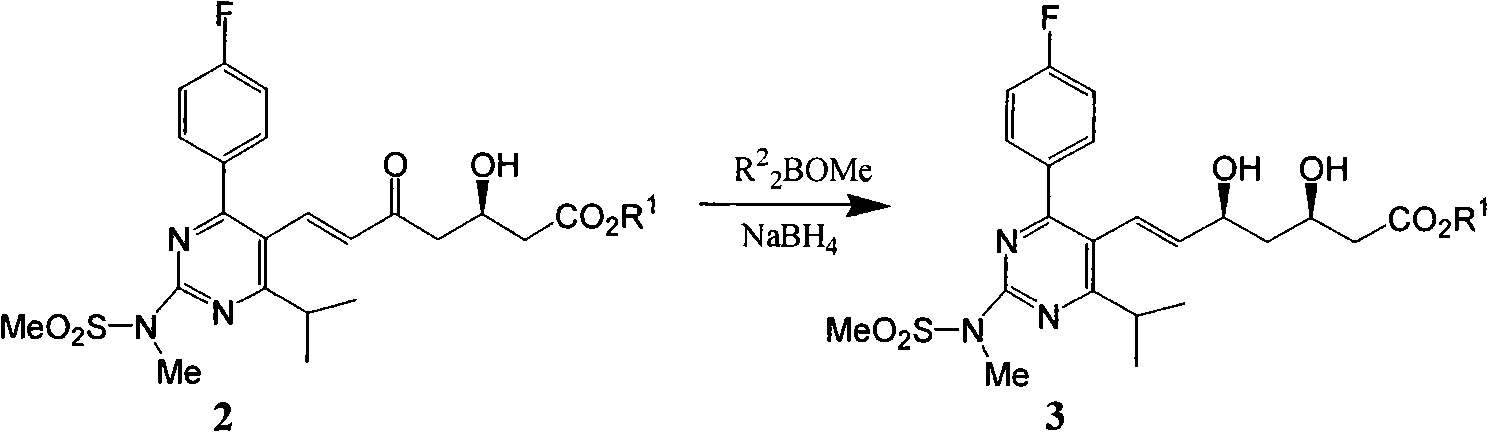
其中R為1-10碳烷基,苄基等。其中R為C2-8烷基:乙基、丙基、丁基、異丁基、1,2-二甲基丙基,環己基等。
b)式(3)鹼性水解生成式(4)。
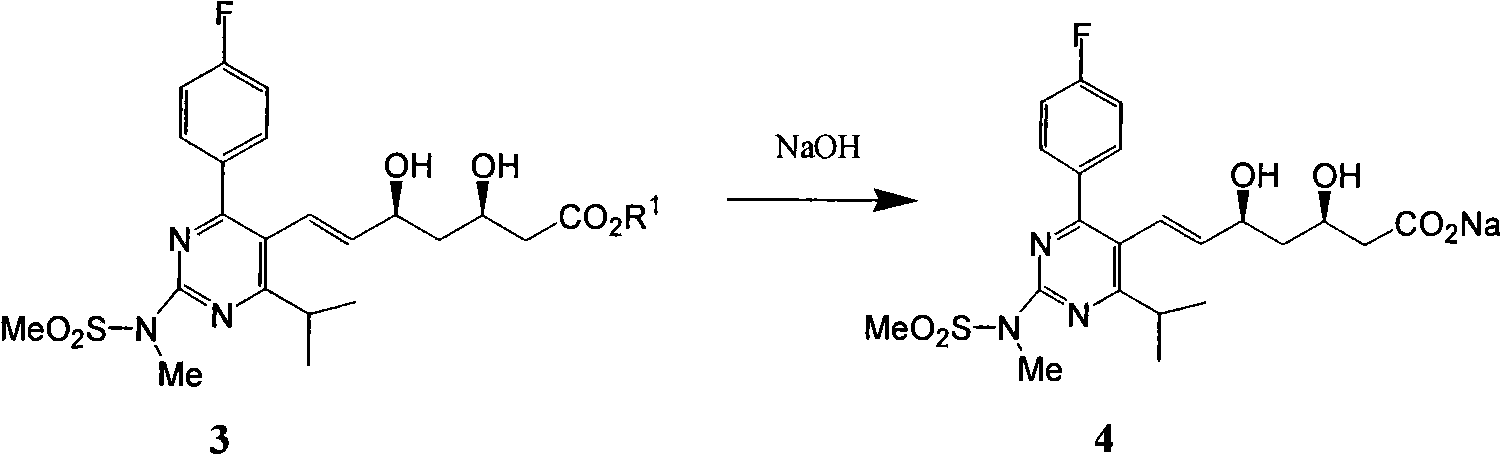
c)式(4)酸化得到式(5)。
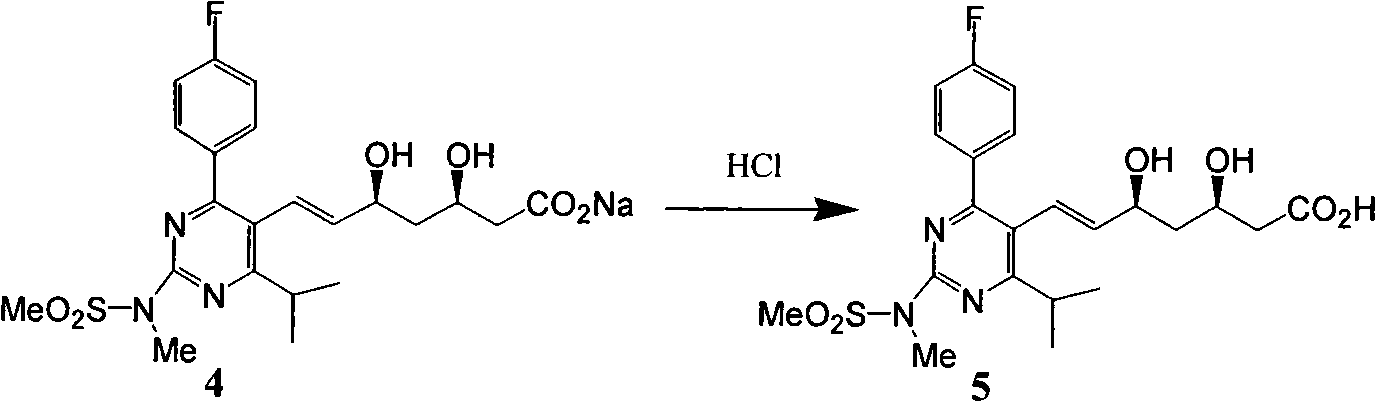
d)式(5)鹼性條件下與鹵代烴反應進行酯化得到式(6)。
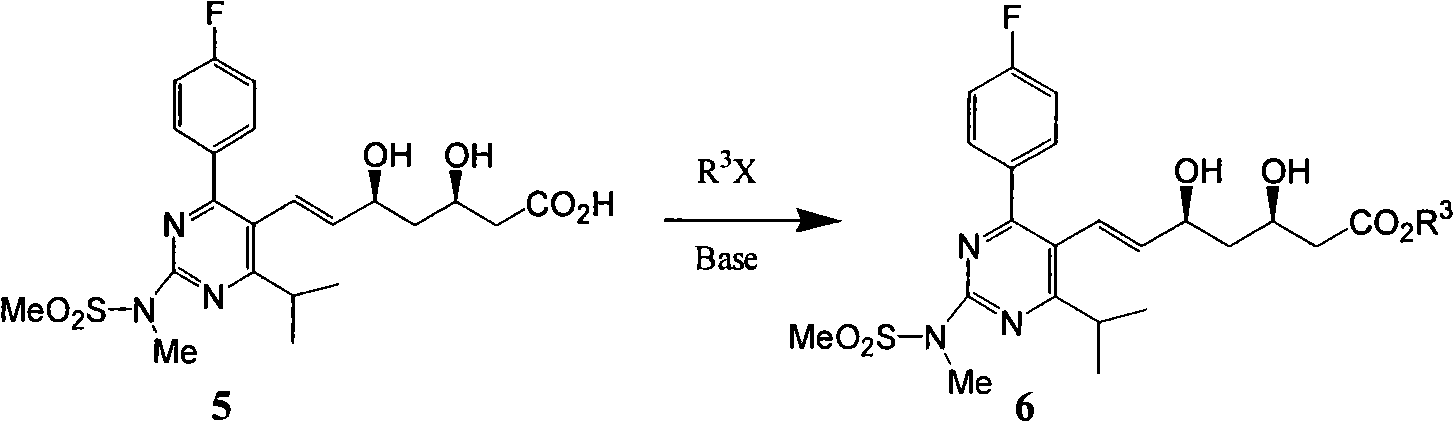
其中R位1-10碳烷基,苄基,X為鹵素Cl,Br,I,TsO,TfO等離去基。
e)式(6)氫氧化鈉鹼性水解再次得到式(4)。
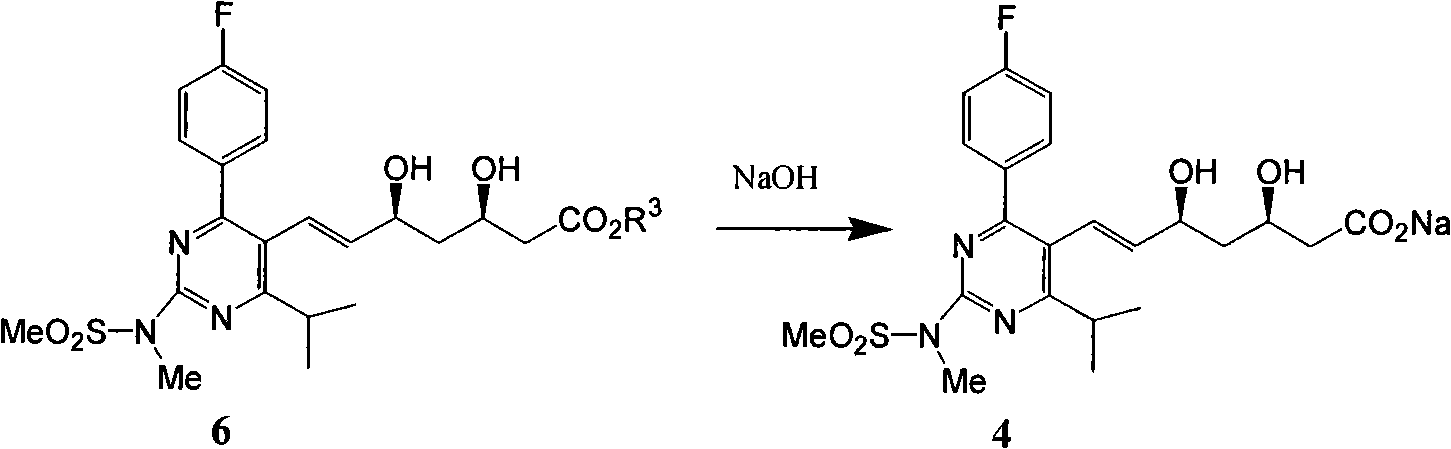
f)式(4)加醋酸鈣轉化為式(1)。
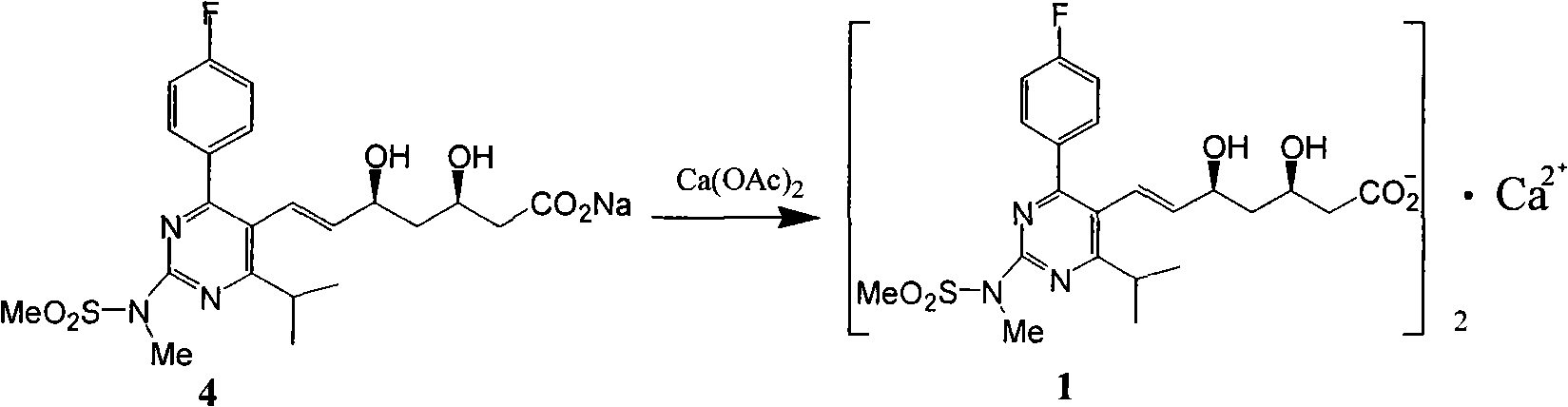
2、權利要求1步驟a)中,採用烷基甲氧基硼絡合下氫負離子轉移還原,烷基甲氧基硼選自二乙基甲氧基硼,二丙基甲氧基硼,二丁基甲氧基硼,二異丁基甲氧基硼,二(1,2-二甲基丙基)甲氧基硼,二環己基甲氧基硼等。
3、權利要求1步驟a)中,還原反應結束後,滴加冰醋酸破壞還原劑,然後減壓蒸餾溶劑,所得混合溶劑可調整比例後直接套用。
4、權利要求1步驟b)中,溶劑選自四氫呋喃、醇類、乙腈等。鹼氫氧化鈉的用量1.05eq~2.0eq,反應溫度-10~80攝氏度。最適宜溶劑宜選用乙腈,氫氧化鈉用量宜為1.1eq,溫度宜在20攝氏度-40攝氏度。
5、權利要求1步驟b)中,用非水互溶溶劑萃取除去雜質,適宜的溶劑如乙酸乙酯、乙醚等。
6、權利要求1步驟c)中,溶劑選自酯類、醚類、鹵代烴,優選乙醚。
7、權利要求1步驟c)中,加入固體弱鹼,碳酸鹽。
8、權利要求1步驟d),鹵代烷為1-8碳烷基,苄基。
9、按照權利要求8,優選溴代異戊烷。
10、權利要求1步驟d),鹼選自碳酸鹽,硫酸氫鹽,磷酸氫鹽,磷酸二氫鹽,有機胺。
11、按照權利要求10,優選碳酸鉀。
12、權利要求1步驟d),溶劑選自酮類、非質子高級性溶劑DMF,DMSO,HMPA等。
13、按照權利要求12,優選丙酮。
14、權利要求1步驟d),反應體系中加入相轉移催化劑,季銨鹽、冠醚、聚乙二醇等。
15、按照權利要求14,優選四丁基溴化銨。
16、權利要求1步驟d),反應溫度範圍-40~80攝氏度
17、按照權利要求16,優選反應溫度20攝氏度。
18、權利要求1步驟d),瑞舒伐他汀酯結晶溶劑選自醚類、酯類、醇類等多種溶劑,以及這些溶劑和烷烴或水組成的混合溶劑。
19、按照權利要求18,優選溶劑乙醚。
20、權利要求1步驟g),溶劑選自四氫呋喃、醇類、乙腈等。鹼氫氧化鈉的用量1.05eq~2.0eq,反應溫度-10~80攝氏度。最適宜溶劑宜選用乙腈,氫氧化鈉用量宜為1.1eq,溫度宜在20攝氏度-40攝氏度。
21、權利要求1步驟g),用非水互溶溶劑萃取除去雜質,適宜的溶劑如乙酸乙酯、乙醚等。
22、權利要求1步驟h),醋酸鈣或二氯化鈣用量為1.0eq~1.2eq。
23、按照權利要求21,優選醋酸鈣用量為1.05eq。
24、權利要求1步驟h),水層經酸化,溶劑提取、氫氧化鈉成鹽,然後轉化為鈣鹽,直接完全回收利用。
25、按照權利要求8-24描述的方法,用於進行提純或再加工瑞舒伐他汀酯、酸、鹽、內酯。
26、按照權利要求1-25,製備瑞舒伐他汀鈣。
以下是對《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》的進一步詳細說明:
瑞舒伐他汀鈣鹽難以通過重結晶手段直接提純,特別是去除非對映體及對映異構體及一些其他特定雜質。2008年5月前已有技術EP0521471通過瑞舒伐他汀鈉在乙醚中打漿成晶體,可以除去一些低極性雜質,但對瑞舒伐他汀鈣異構體及其他特定雜質幾乎不起作用。瑞舒伐他汀鈣可以在乙腈-水中結晶(WO0042024),但結晶對純度提高幫助不大。2008年5月前已有技術表明及試驗表明,通過瑞舒伐他汀銨鹽或其他鹽可以起到純化作用(WO0160804),對大部分雜質來說有效,但對光降解雜質及光學異構體基本上不起作用。通過轉化為瑞舒伐他汀內酯(WO2005068435),進行精製,可以除掉部分雜質,但仍然對異構體及一些特定雜質效果亦不顯著。因此,基於專利EP0521471的瑞舒伐他汀鈣的合成工藝中,控制瑞舒伐他汀酯的純度是必要的,尤其是非對映體含量的控制。
按照專利EP0521471及2008年5月前已有技術,用(3R,6E)-7-[4-(4-氟苯基)-6-(1-甲基乙基)-2-[甲基(甲基磺醯基)氨基]-5-嘧啶基]-3-羥基-5-氧代-6-庚烯酸甲酯還原得到的瑞舒伐他汀甲酯為油狀物,難以直接重結晶。按照該專利即使瑞舒伐他汀甲酯柱層析純化,最後得到的瑞舒伐他汀鈣的質量也不高,非對映體含量一般大於0.5%,其他雜質總合一般大於1.5%。根據文獻報導採用二乙基甲氧基硼烷絡合下硼氫化鈉不對稱還原,選擇性雖然很高,一般大於98:2,但仍然難以避免還原過程會產生非對映異構體,一般非對映異構體的含量在0.5-2.0%之間,要獲得較高非對映純度(de值),必須經過重結晶等手段進行純化。
該申請人發現幾乎所有瑞舒伐他汀酯均能夠結晶,但這些酯的性質特別是結晶性能方面存在較大差別。其中瑞舒伐他汀甲酯最難結晶,一般來說純度低於80%,結晶幾乎成為不可能,純度低於95%,結晶相對較慢,需要加入晶種誘導或長時間攪拌,如果純度很高則也可以在多中溶劑中結晶。瑞舒伐他汀乙酯、丙酯、異丙酯、正丁酯、仲丁酯、異丁酯、叔丁酯均具有較好的結晶性能。而瑞舒伐他汀異戊酯具有更優良的的結晶性能,即使純度較低也容易在多中溶劑中結晶析出。申請人認為,解決瑞舒伐他汀酯的質量控制問題可以採用不同酯得以實現。在側鏈手性原料(R)-3-[[(1,1-二甲基乙基)二甲基矽基]氧基]-5-氧代-6-(三苯基亞磷基)-己酸酯上作出改變,採用乙酯或其他酯均存在一定的技術上困難,專利WO03087112報導側鏈採用叔丁酯,按照該專利側鏈的製備工藝仍然非常困難。而由瑞舒伐他汀酯直接進行酯交換反應副反應較多,沒有實際意義。申請人研究發現瑞舒伐他汀酸能夠高產率酯化,最佳化改進的條件下甚至能夠達到99.0%左右的轉化率,這樣的轉化儘管增加了操作步驟,但並沒有因此損失大量產品。因此,申請人對EP0521471工藝路線進行了改進:羥基酮不對稱還原為瑞舒伐他汀酯粗品後,鹼性水解得到瑞舒伐他汀鈉鹽,經溶劑提取除去雜質得到瑞舒伐他汀鈉鹽溶液,然後將鈉鹽酸化轉化為瑞舒伐他汀酸,將瑞舒伐他汀酸在鹼性條件下和鹵代烴和其他烷基化試劑反應再次高產率轉化為瑞舒伐他汀酯,通過重結晶等純化手段得到純的瑞舒伐他汀酯。將純的瑞舒伐他汀酯再水解成瑞舒伐他汀鈉鹽,最後轉化為瑞舒伐他汀鈣鹽。改進的合成路線示意如下:
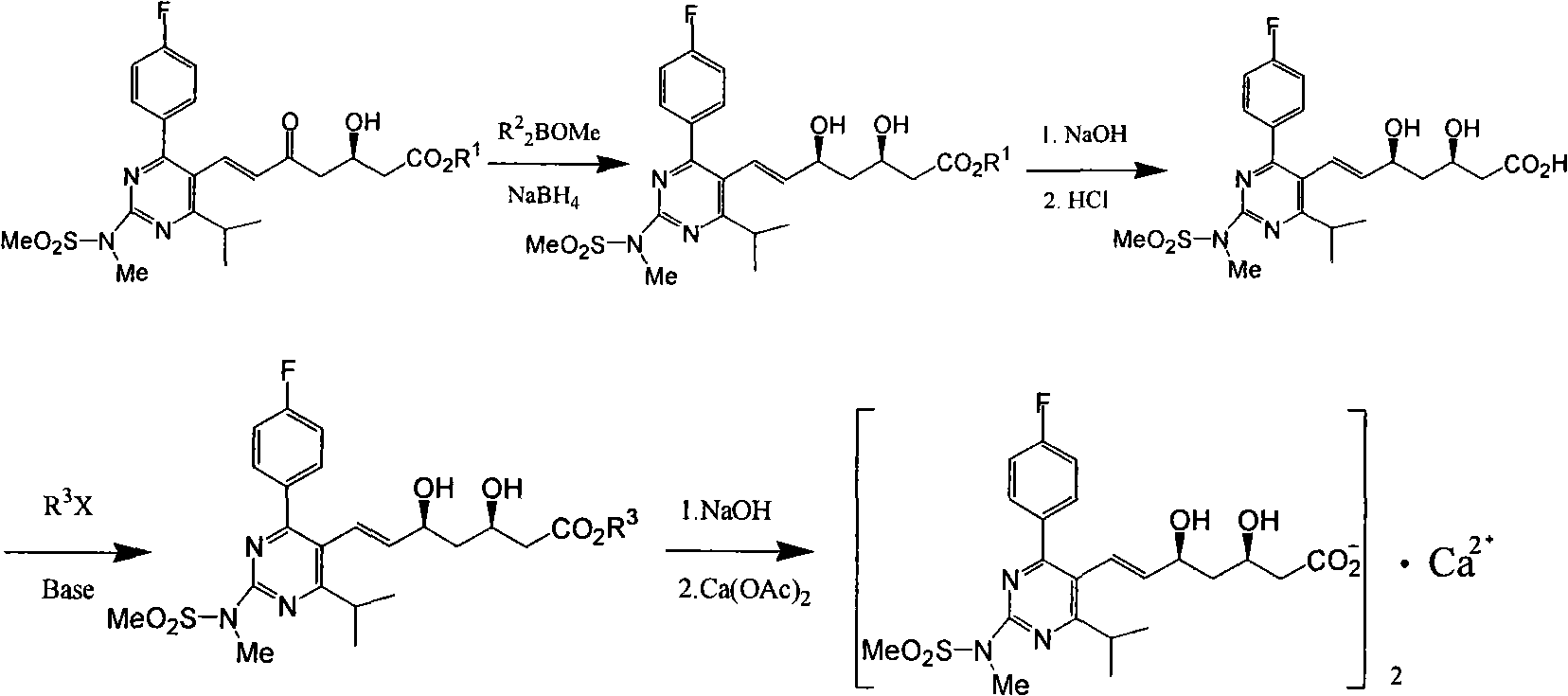
通過這樣的轉化,結果是可以去除了對結晶非常不利的粗品瑞舒伐他汀酯中的大部分雜質,如果有必要可把結晶困難的酯轉化為結晶容易的酯。非對映異構體和其他雜質均可以容易的通過對新生成的酯進行重結晶操作而去除。得到純度足夠瑞舒伐他汀酯用於瑞舒伐他汀鈣的製備。
具體來說:
參考EP0521471,採用四氫呋喃和甲醇作溶劑,在低溫-78攝氏度下,加入二烷基甲氧基硼,然後硼氫化鈉等還原劑,TP-13還原得到瑞舒伐他汀甲酯,不同的硼試劑得到不同的選擇性,一般來水,烷基越大,空間越擁擠,選擇性越高。二烷基甲氧基硼選自二乙基甲氧基硼,二丙基甲氧基硼,二丁基甲氧基硼,二異丁基甲氧基硼,二(1,2-二甲基丙基)甲氧基硼,二環己基甲氧基硼等。反應低溫必要,反應溶劑一般以四氫呋喃和甲醇的比例為2:1-5:1之間,優選3:1-4:1,溶劑量大一般有利,一般在10-80倍量,優先30-50倍量。
瑞舒伐他汀酯鹼性水解溶劑可以選用自四氫呋喃、醇類、乙腈等,鹼氫氧化鈉的用量1.05eq~2.0eq,反應溫度-10~80攝氏度。最適宜溶劑宜選用乙腈,氫氧化鈉用量宜為1.1eq,溫度宜在20攝氏度-40攝氏度。反應結束後,調節pH後,用非水互溶溶劑萃取除去雜質,適宜的溶劑如乙酸乙酯、乙醚等。
瑞舒伐他汀酸為糖漿狀物,並且穩定性差,容易轉化為瑞舒伐他汀內酯。瑞舒伐他汀鈉鹽轉化為酸適宜的條件是,水溶液中加入與水不互溶的溶劑,適宜的溶劑有乙醚/乙酸乙酯等。加入無機酸或者有機酸,使瑞舒伐他汀酸游離出來,並不斷攪拌溶解於有機溶劑中。適宜的酸有鹽酸/硫酸,甲酸,冰醋酸等。控制pH在1~6,最適宜的pH為3~5。靜置分液,水層用有機溶劑萃取,合併有機層。乾燥劑乾燥。加入適量鹼,鹼選自碳酸鈉,碳酸鉀等弱鹼,可以控制內酯化的速度。控制溫度不超過60攝氏度,更適宜的溫度不超過40攝氏度,減壓濃縮。
瑞舒伐他汀酸進行酯化不宜採用酸性條件。酸性條件下,特別是強酸較高溫度條件,瑞舒伐他汀酸極易轉化為內酯,烯丙位(5-羥基位)消旋化也非常容易發生。瑞舒伐他汀酸製備瑞舒伐他汀酯宜選用鹼性或中性酯化條件,在這些條件下,內酯化趨勢仍然明顯,生成的酯在鹼性條件長時間較高溫度條件仍能轉化為內酯。為解決這些問題,申請人作了詳細研究,低雜質,高產率合成了瑞舒伐他汀酯。高產率是重要的,因為瑞舒伐他汀酸的製造成高,如果能達到97~99%的轉化率,這樣的轉化才值得。瑞舒伐他汀的有效利用率並沒有因為兩步操作明顯降低,酯水解成鈉鹽的瑞舒伐他汀有效率能達到97%~99%,兩步總收率大於94%。瑞舒伐他汀酸與烷基化試劑在鹼性條件酯化,適宜的鹵代烷中鹵原子為氯、溴、碘,更適宜的為溴、碘,適宜的其他烷基化試劑如:烷基對甲苯磺酸酯,烷基三氟甲磺酸酯等。適宜的鹼性化合物可以是強鹼弱酸鹽,如碳酸鈉,碳酸氫鈉,碳酸鉀,碳酸氫鉀等,有機鹼,如三乙胺等。適宜的溶劑可以選自酮、酯、DMF等非醇類溶劑。適宜的配比鹵代烴1.0eq~5.0eq,鹼1.0eq~3.0eq。適宜的反應溫度為-40~80攝氏度。當固體鹼在溶劑中溶解度差時,加入相轉移催化劑能夠促進反應的進行,相轉移催化劑可以選擇季銨鹽、冠醚等。最佳化的條件是鹵代烴1.1eq~3.0eq,鹼1.0eq~1.5eq。適宜的反應溫度為0~40攝氏度,相轉移催化劑用量為0.2eq~1.5eq。對用碘甲烷製備甲酯,最佳條件:碘甲烷3.0eq,碳酸鉀1.2eq,反應溫度為20攝氏度,相轉移催化劑四丁基溴化銨1.0eq。對採用溴代異戊烷製備異戊酯時,最佳條件為溴代異戊烷2.5eq,碳酸鉀1.1eq,反應溫度為40攝氏度,相轉移催化劑四丁基溴化銨0.5eq,及碘化鉀0.5eq。
瑞舒伐他汀酯水解製備鈉鹽,適宜的溶劑可選自四氫呋喃、醇類、乙腈等。鹼選用氫氧化鈉,氫氧化鈉的用量1.05eq~2.0eq,反應溫度-10~80攝氏度。最適宜溶劑宜選用乙腈,氫氧化鈉用量宜為1.1eq,溫度宜在20攝氏度-40攝氏度。反應結束後,用無機酸或有機酸調節pH值,pH值控制在7-11,最佳為9。用非水互溶溶劑萃取除去雜質,適宜的溶劑如乙酸乙酯、乙醚等。減壓濃縮除去殘留水中的有機溶劑,得到純的鈉鹽水溶液。
醋酸鈣的用量宜控制在1.05eq-1.3eq,最適宜的是1.1eq,水層可以直接用酸酸化,加溶劑提取,濃縮,將酸轉化為鈉鹽水溶液,再次製備瑞舒伐他汀鈣。水層回收的產品質量與直接製備的產品質量相當。得到的純的瑞舒伐他汀酯幾乎可以實現定量利用。
改善效果
通過這些技術製備瑞舒伐他汀鈣可以獲得很大益處。採用改進的方法對中間體的質量要求大幅度降低,前面的中間體(3R,6E)-3-[[(1,1-二甲基乙基)二甲基矽基]氧基]-7-[4-(4-氟苯基)-6-(1-甲基乙基)-2-[甲基(甲基磺醯基)氨基]-5-嘧啶基]-5-氧代-6-庚烯酸酯,(3R,6E)-7-[4-(4-氟苯基)-6-(1-甲基乙基)-2-[甲基(甲基磺醯基)氨基]-5-嘧啶基]-3-羥基-5-氧代-6-庚烯酸酯可以不經過柱層析和重結晶純化,純度較低也是可以接受的,這樣得到的瑞舒伐他汀酯粗品也可用於瑞舒伐他汀成品的製備。基於專利EP0521471的合成瑞舒伐他汀鈣的方法具備較寬操作條件,避免苛刻的條件控制,整個生產流程中均不使用柱層析。工藝容易控制,產品質量穩定可靠,成本可以接受,真正能夠適應大規模製造。通過這些技術,使基於專利EP0521471的合成路線能夠製備高純度瑞舒伐他汀鈣,典型純度大於99.5%,通過多次精緻可以合成基本上不含雜質的瑞舒伐他汀鈣(99.9%)。
這些技術可以套用於:瑞舒伐汀鈣的製備及不合格瑞舒伐他汀鈣的再加工。當採用其他合成方法合成的瑞舒伐他汀酯純度不夠時,當瑞舒伐他汀內酯純度不高時,當合成的瑞舒伐他汀各種鹽質量不符合要求時,採用水解等方法,轉化為瑞舒伐他汀酸,按照前面描述的方法進行處理,得到質量更高的產品。
附圖說明
附圖1為:典型RSPHPLC有關物質圖譜;
附圖2為:典型RSHPLC有關物質圖譜。
技術領域
《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》涉及瑞舒伐他汀鈣的製備方法。該發明基於EP0521471提供的合成方法,通過不對稱還原的改進,合成了瑞舒伐他汀酯,水解酯製備瑞舒伐他汀游離酸,經提純得到瑞舒伐他汀鈉鹽溶液,然後將鈉鹽轉化為瑞舒伐他汀酸,將初步純化的瑞舒伐他汀酸再次高產率轉化為瑞舒伐他汀酯,通過重結晶等純化手段得到純的瑞舒伐他汀酯。將純的瑞舒伐他汀酯再水解成瑞舒伐他汀鈉鹽,最後轉化為瑞舒伐他汀鈣鹽。該發明提供的瑞舒伐他汀鈣的製備方法,不僅產率高,成本低,質量高,而且革除了工藝中需要柱層析等難大規模製造的操作,使基於EP0521471的工藝路線能夠真正適應工業化生產。
權利要求
1、一種製備式(1)所示的分子的方法,其包括:
a)式(2)所示的分子在二烷基甲氧基硼絡合下氫負子轉移不對稱還原生成式(3)。
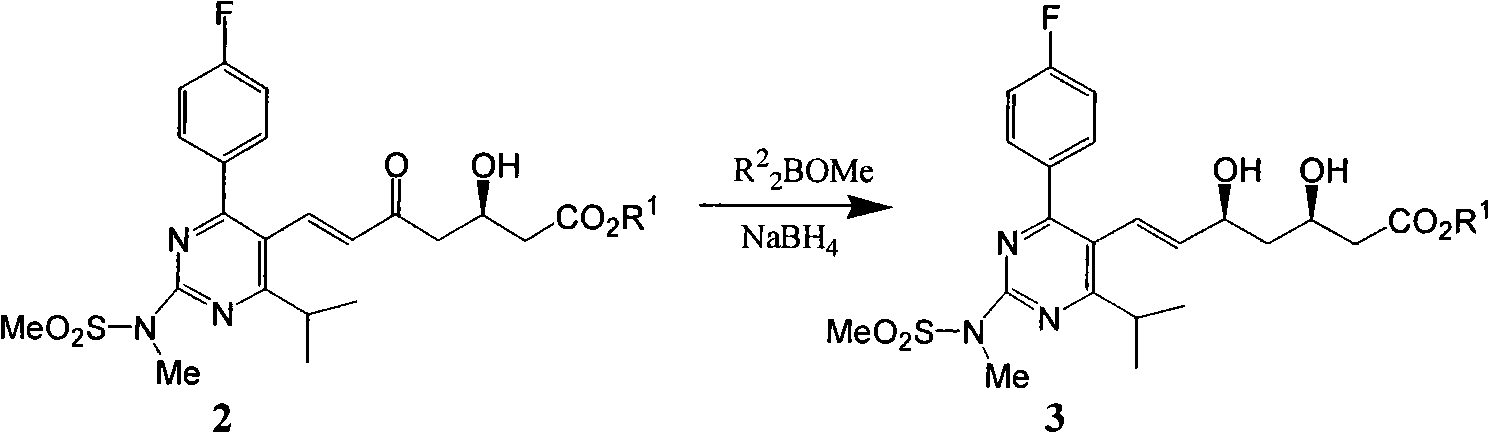
其中R為1-10碳烷基,苄基,其中R為C2-8烷基:乙基、丙基、丁基、異丁基、1,2-二甲基丙基,環己基;
b)式(3)鹼性水解生成式(4):
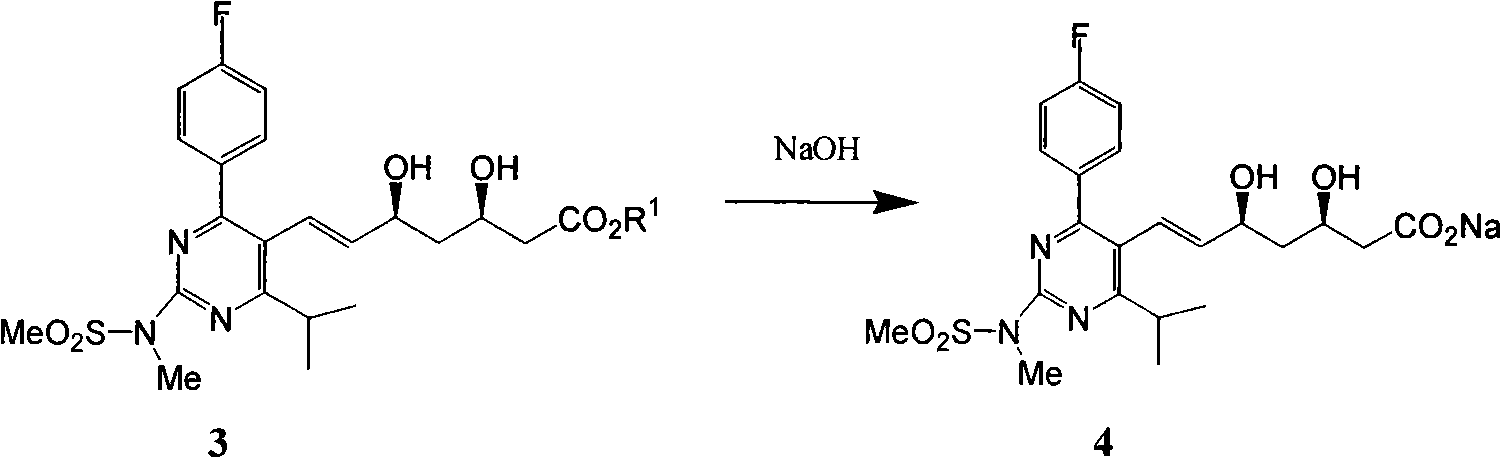
c)式(4)酸化得到式(5):
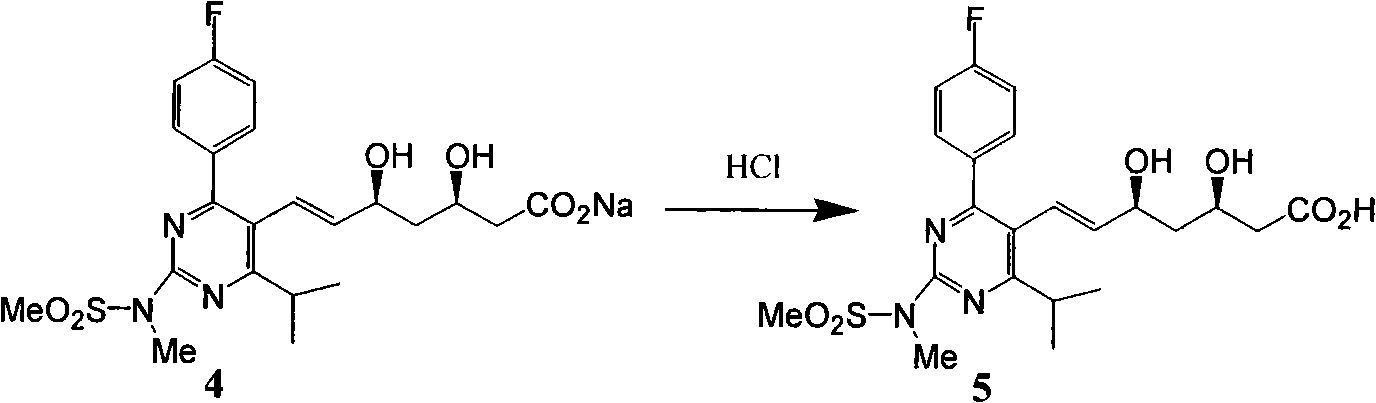
d)式(5)鹼性條件下與鹵代烴反應進行酯化得到式(6):
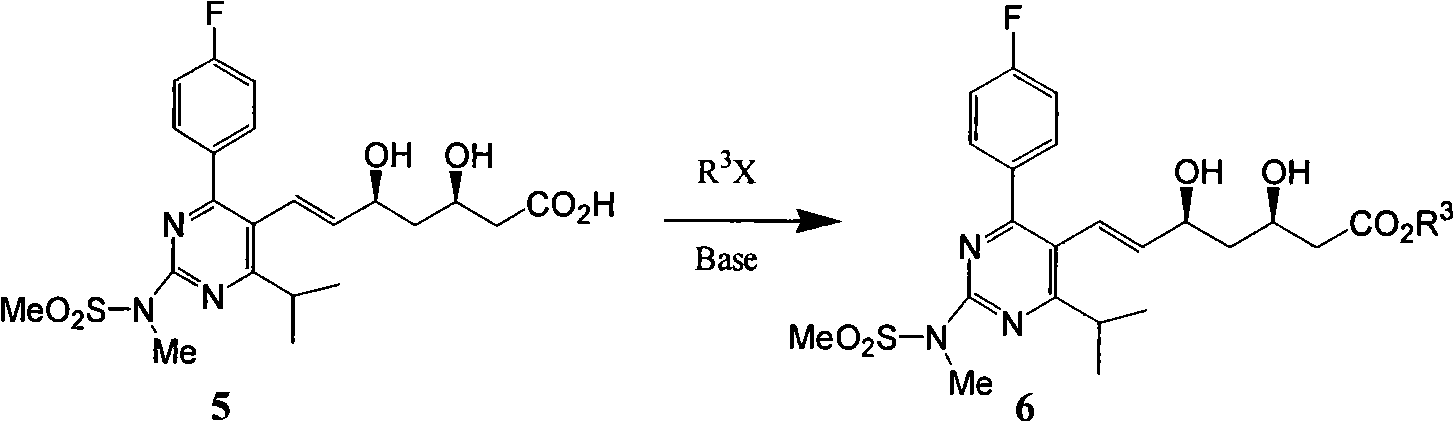
其中R位1-10碳烷基,苄基,X為鹵素Cl,Br,I,TsO,TfO;
e)式(6)氫氧化鈉鹼性水解再次得到式(4):
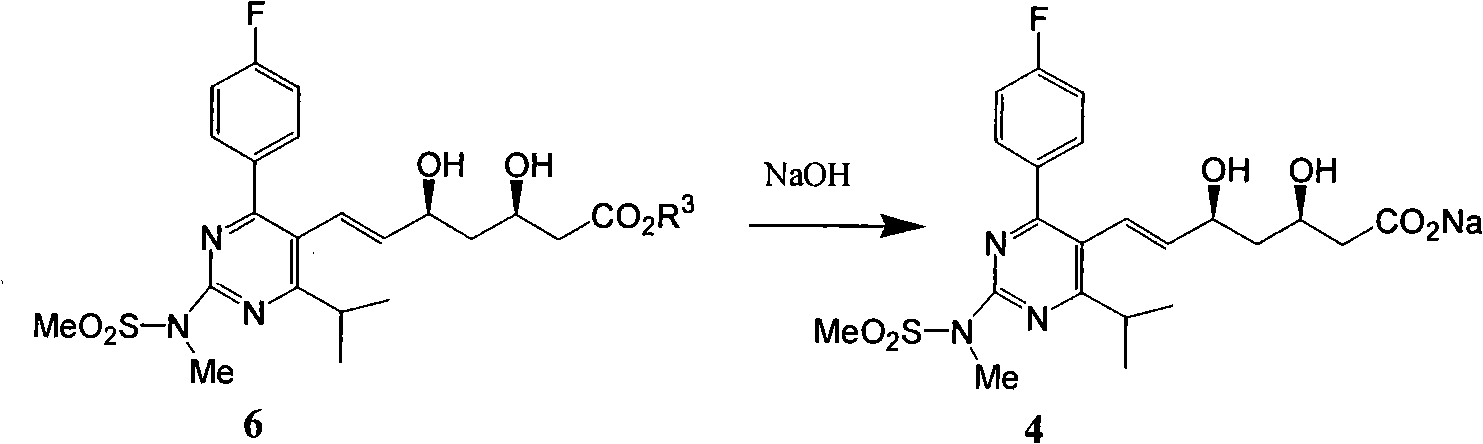
f)式(4)加醋酸鈣轉化為式(1):
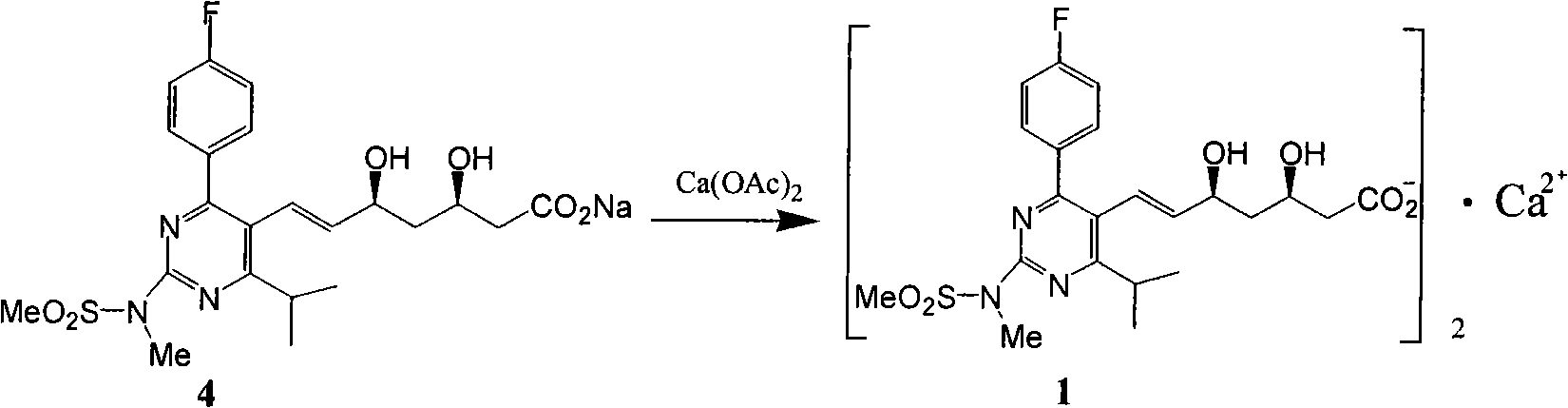
2.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟a)中,採用烷基甲氧基硼絡合下氫負離子轉移還原,烷基甲氧基硼選自二乙基甲氧基硼,二丙基甲氧基硼,二丁基甲氧基硼,二異丁基甲氧基硼,二(1,2-二甲基丙基)甲氧基硼,二環己基甲氧基硼。
3.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟a)中,還原反應結束後,滴加冰醋酸破壞還原劑,然後減壓蒸餡溶劑,所得混合溶劑可調整比例後直接套用。
4.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟b)中,溶劑為四氫呋喃、醇類或乙腈,鹼氫氧化鈉的用量1.05eq〜2.00eq,反應溫度-10〜80攝氏度。
5.如權利要求4所述的一種製備式(1)所示的分子的方法,其中步驟b)中,溶劑為乙臘,氫氧化鈉的用量宜為1.1eq,溫度為20攝氏度-40攝氏度。
6.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟b)中,用非水互溶溶劑萃取除去雜質,所述非水互溶溶劑為乙酸乙酯和乙醚。
7.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟c)中,溶劑為酯類、醚類或鹵代烴。
8.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟c)中,溶劑為乙醚。
9.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟d),R為1-8碳烷基或苄基。
10.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟d),Rx為溴代異戊烷。
11.如權利要求1所述的一種製備式(1)所示的分子的方法,其中步驟d),鹼為碳酸鹽,磷酸氫鹽,磷酸二氫鹽或有機胺。
實施方式
實施例
1、還原

向500毫升乾燥反應瓶中加入無水THF300毫升和無水甲醇85毫升,加入6.3克TP-13,以氮氣置換反應體系,攪拌至TP-13全部溶解。用液氮降溫至-80~-85攝氏度,滴加1M二乙基甲氧基硼烷四氫呋喃溶液12.8毫升,控制滴加速度以保持溫度於-80~-85攝氏度之間,約30分鐘滴完。維持溫度-80~-85攝氏度繼續攪拌55~60分鐘。然後均勻分批加入0.7克硼氫化鈉,約80~90分鐘加完後,維持溫度-80~-85攝氏度,這一過程大約需要5.5~6小時,反應結束。在2小時內升溫至20~30攝氏度,繼續保溫反應2~3小時後,加入1.2克冰醋酸後,45~55攝氏度下減壓蒸餾以除去甲醇-四氫呋喃混合有機溶劑。加入50毫升甲醇溶解油狀物,45~55攝氏度下減壓蒸餾以除去甲醇。再次加入50毫升甲醇溶解油狀物,45~55攝氏度下減壓蒸餾以除去甲醇,得到油狀物殘留於釜中。
然後加入50毫升乙酸乙酯和50毫升水,攪拌10~15分鐘,靜置分液,水層用乙酸乙酯提取(30毫升×2),每次攪拌10~15分鐘,靜置分液,合併有機層,依次用飽和碳酸氫鈉水溶液洗滌(40毫升×1),飽和氯化鈉水溶液洗滌(40毫升×2),每次攪拌10~15分鐘,靜置分液,水層棄去,有機層加入2克無水硫酸鈉攪拌30分鐘,抽濾除去無水硫酸鈉。濾液40~50攝氏度下減壓蒸餾以除去乙酸乙酯有機溶劑,得6.0克RSM油狀物。
2、水解
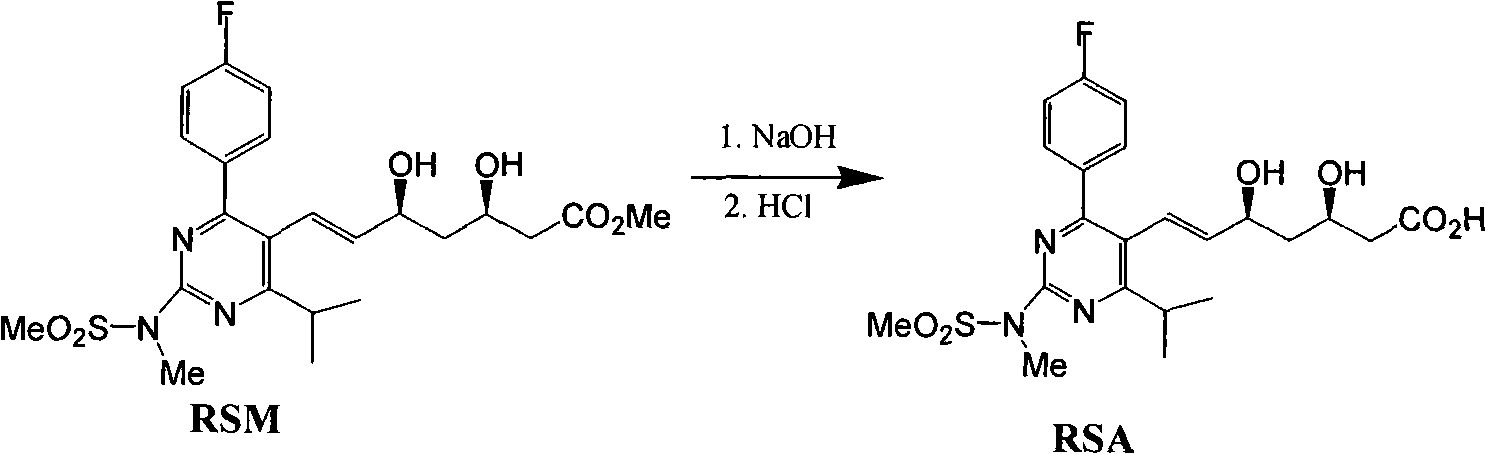
向500毫升反應瓶中加入150毫升乙腈,加入18克RSM,待完全溶解後,加入40毫升純化水,加熱至35~40攝氏度,開始滴加1N氫氧化鈉溶液42毫升,控制滴加速度以保持溫度於35~40攝氏度之間(整個滴加過程大約需要10~15分鐘),繼續反應大約需要2~2.5小時,反應結束,40~50攝氏度下減壓蒸餾以除去乙腈有機溶劑,然後加純化水30毫升,開夾套冷卻水降內容物溫度至25~30攝氏度,用乙醚洗滌(50毫升×3),每次攪拌10~15分鐘,靜置分液,收集水層,然後加入3克活性炭,加熱維持溫度35~40攝氏度,攪拌50~60分鐘,抽濾,用10毫升純化水洗滌濾餅,合併濾液及洗液,冷卻至15~20攝氏度,加入90毫升乙醚,用0.5N鹽酸調pH在4~5之間,攪拌10~15分鐘,靜置分液,水層用乙醚提取(60毫升×2),每次攪拌10~15分鐘,靜置分液,合併有機層,用飽和氯化鈉溶液洗滌(60毫升×2),靜置分液,水層棄去,向有機層中加入6克無水硫酸鈉攪拌30~35分鐘,抽濾除去無水硫酸鈉,濾液20~30攝氏度下減壓蒸餾以除去乙醚有機溶劑,加入50克DMF,加入碳酸鉀2.5克,20~30攝氏度下減壓蒸餾1~2小時以除去乙醚,得RSA的DMF溶液約69.6克。
3、酯化
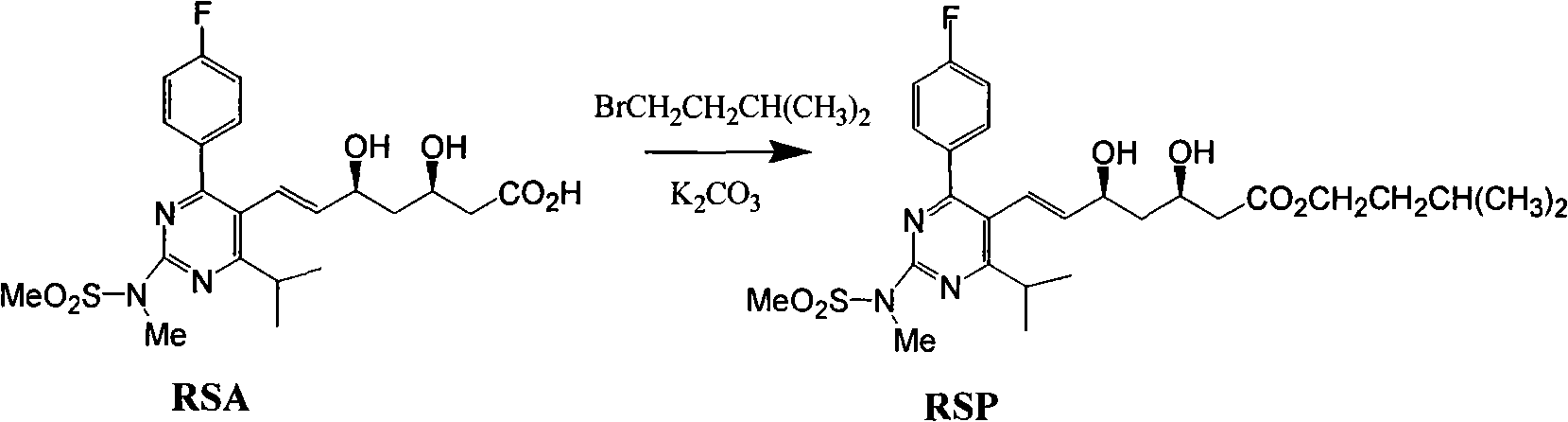
500毫升反應瓶中加入DMF200毫升,加入約含17.1克RSA和碳酸鉀2.5克的DMF溶液69.6克,26.8克溴代異戊烷,四丁基溴化銨,碘化鉀,加熱至35~40攝氏度,開始反應,直至TLC顯示反應液中原料RSA含量≤1%,這一過程大約需要1.5~2.5小時。依次向反應液中加入660毫升水和340毫升乙酸乙酯,攪拌10~15分鐘,靜置分液,水層用乙酸乙酯提取(100毫升×2),合併乙酸乙酯有機層,用飽和氯化鈉溶液洗滌(180毫升×3),每次攪拌10~15分鐘,靜置分液,向有機層中加入9克無水硫酸鈉攪拌30~35分鐘,抽濾除去無水硫酸鈉。濾液轉移至500毫升搪玻璃濃縮釜,開啟真空,維持真空度-0.080~-0.085兆帕,打開夾套蒸汽加熱將溫度升至40~50攝氏度下減壓蒸餾以除去有機溶劑乙酸乙酯。將殘留料液抽至100毫升搪玻璃釜中,加入80毫升異丙醚攪拌溶解,升內容物溫度至68~75攝氏度,在2~3小時內降料液內溫至0~5攝氏度,停止攪拌,靜置析晶8~12小時,然後攪拌50~60分鐘,抽濾,真空乾燥,得到15.2克RSP粗品。
向100毫升反應瓶中加入130毫升乙醚和1.6毫升乙腈,投入上述烘乾的RSP粗品,升溫回流溶解,攪拌30~35分鐘,常壓蒸出25~29毫升乙醚和乙腈的混合溶劑,停止攪拌,在2~3小時內冷卻至0~5攝氏度,靜置析晶8~12小時。抽濾,濾餅每次用5毫升乙醚洗滌兩次得到RSP濕品。35~40攝氏度下真空乾燥約3~5小時,得到12.5克RSP。
4、成品製備
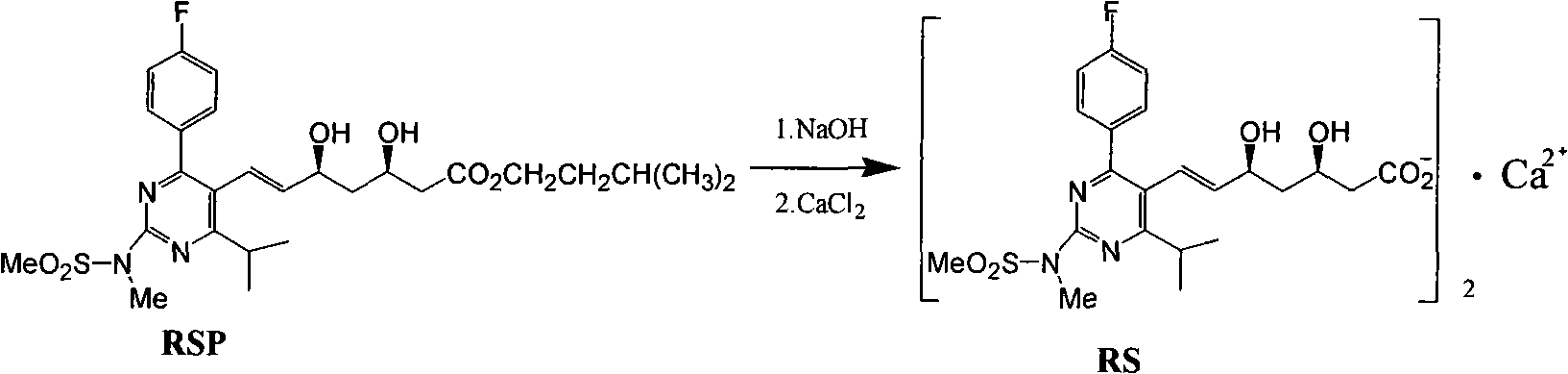
向200毫升反應瓶中加入80毫升乙腈,開啟攪拌,加入12.5克RSP,加熱至35~40攝氏度,加入25毫升純化水,開始滴加1N氫氧化鈉溶液25毫升,控制滴加速度以保持溫度於35~40攝氏度之間(整個滴加過程大約需要10~15分鐘),維持料液溫度35~40攝氏度繼續反應,這一過程大約需要2~2.5小時,35~40攝氏度下減壓蒸餾以除去有機溶劑乙腈,然後向殘餾物中加純化水25毫升,用0.5N冰醋酸溶液約3克調節料液的pH為9,開夾套冷卻水降內容物溫度至25~30攝氏度,水層用乙醚洗滌(30毫升×3),每次攪拌10~15分鐘,靜置分液,水層維持真空度-0.080~-0.085兆帕,打開夾套蒸汽加熱將溫度升至30~40攝氏度下減壓蒸餾以除去殘留乙醚,水層抽濾至成鹽釜中,用20毫升純化水洗滌反應釜和管道,合併洗液和濾液降溫至15~20攝氏度,滴加已過濾的1N醋酸鈣溶液13.5毫升,控制滴加速度以保持溫度於15~20攝氏度之間(整個滴加過程大約需要25~30分鐘),然後維持料液溫度15~20攝氏度攪拌2小時,抽濾,固體用15-20攝氏度純化水40毫升打漿後抽濾。真空乾燥,得RS7.3克。母液合併按下法進行處理。
5、母液回收
母液加入1000毫升反應瓶中,加入200毫升乙醚,用0.5N鹽酸調節水層的pH在3~4之間,攪拌10~15分鐘,靜置分液。水層用乙醚洗滌(100毫升×2),每次攪拌10~15分鐘,靜置分液,合併有機層,用純化水洗滌(150毫升×2),每次攪拌10~15分鐘,靜置分液,水層棄去,有機層加入4克無水硫酸鈉攪拌30分鐘,抽濾除去無水硫酸鈉,濾液濃縮。35~40攝氏度下蒸餾以除去有機溶劑乙醚,蒸出約250~300毫升為止,然後向殘餾物中加純化水40毫升,開夾套冷卻降內容物溫度至25~30攝氏度,滴加1N的氫氧化鈉溶液約7.5~9.2毫升,維持pH10~11,攪拌50~60分鐘,用0.5N冰醋酸溶液2克調節料液的pH為9,靜置分液。水層用乙醚洗滌(10毫升×2),每次攪拌10~15分鐘。靜置分液,水層30~40攝氏度下減壓蒸餾以除去殘留乙醚,降溫至15~20攝氏度,開始滴加已過濾的滴加已過濾的1N醋酸鈣溶液4~5毫升,控制滴加速度保持溫度於15~20攝氏度之間(整個滴加過程大約需要25~30分鐘),然後維持料液溫度15~20攝氏度攪拌2小時固體用15~20攝氏度純化水10毫升打漿後抽濾,得到成品的濕品。真空乾燥2.5克。
榮譽表彰
2013年,《一種3,5-二羥基庚-6-烯酸衍生物的製備方法》獲得第八屆江蘇省專利項目獎優秀獎。

