《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》是天津科技大學於2012年7月17日申請的發明專利,該專利申請號為2012102469096,公布號為CN102787130A,公布日為2012年11月21日,發明人是劉逸寒、路福平、樊帥、徐艷靜、胡博、王春霞、王建玲。
《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》的技術方案是利用重組DNA技術定點突變地衣芽孢桿菌耐高溫α-澱粉酶基因,得到耐高溫α-澱粉酶耐酸性突變基因,即耐酸性高溫α-澱粉酶基因,並利用枯草芽孢桿菌表達系統,分泌表達耐酸性高溫α-澱粉酶的方法。該發明解決了2012年7月前耐高溫α-澱粉酶耐酸性較差,耐高溫與耐酸性無法同時兼顧,造成套用受限的問題,滿足了一些在酸性和高溫環境下進行澱粉原料液化工藝的要求,可提高產品收得率及質量,簡化工藝。
2021年6月24日,《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》獲得第二十二屆中國專利優秀獎。
(概述圖為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》摘要附圖)
基本介紹
- 中文名:一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法
- 申請人:天津科技大學
- 發明人:劉逸寒、路福平、樊帥、徐艷靜、胡博、王春霞、王建玲
- 申請號:2012102469096
- 申請日:2012年7月17日
- 公布號:CN102787130A
- 公布日:2012年11月21日
- 地址:天津市濱海新區泰達開發區第十三大街29號天津科技大學
- 代理機構:天津盛理智慧財產權代理有限公司
- 代理人:王來佳
- Int. Cl.:C12N15/56、C12N15/10、C12N1/21、C12N9/28、C12R1/125、C12R1/10
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,附圖說明,技術領域,權利要求,實施方式,專利榮譽,
專利背景
α-澱粉酶(α-1,4-glucan-4-glucanohyddrolase EC 3.2.1.1)能夠以澱粉為底物,從澱粉內部水解α-1,4葡萄糖苷鍵,生成麥芽糖、麥芽三糖、糊精等還原糖。澱粉在α-澱粉酶的作用下,分離迅速降解,粘度下降,即完成液化。α-澱粉酶可由微生物發酵產生,也可由植物、動物提取。截至2012年7月,工業生產上大都以微生物發酵大規模生產α-澱粉酶。枯草桿菌、地衣芽孢桿菌、嗜熱脂肪芽孢桿菌、米麴黴、黑麴黴等都是具有使用價值的α-澱粉酶產生菌,其中地衣芽孢桿菌生產的α-澱粉酶因具有熱穩定性而被優選使用。耐高溫的α-澱粉酶由於具有相當高的熱穩定性,因此自從1973年開始投入生產以來,可被廣泛套用於製糖、釀造、有機酸等以澱粉為原料的深加工工業,是工業上用途最為廣泛的酶種之一。
在實際生產中,澱粉經糊化後的自然pH常常在4.5左右,但一般α-澱粉酶最適pH為6.5,所以液化前需加要鹼提高pH值。2012年7月前,中國國內外使用量最大的來源於黑麴黴的糖化酶最適pH為4.3-4.8,這就要求澱粉液化後,在進行糖化酶糖化前,必須再將pH值調回到4.5左右。且液化中低pH條件有利於減少影響糖液質量的糠醛、氨基葡萄糖等色素物質的形成,提高糖液質量。同時,pH的反覆調節既增加了操作步驟,也增大了化學試劑的消耗,需要在最後的終產物處理中利用離子交換將多餘的鹽分除去。為了給澱粉原料深加工提供更好地工藝條件,提高產品質量和收得率、降低消耗、增加效益、特別是節約工業用糧,開發一種耐酸性高溫α-澱粉酶,從而滿足一些在酸性條件下進行澱粉原料液化工藝的要求,就顯得勢在必行。
截至2012年7月,研究者主要通過菌種選育和基因工程手段,改善耐高溫α-澱粉酶。德國Nielsen經定點突變後獲得地衣芽孢桿菌耐高溫α-澱粉酶突變體Y290E,在酸性條件下活力提高,但耐熱性能降低。美國Richardson從各地深海及酸性土壤環境微生物構建的宏基因組文庫中篩選得到三個α-澱粉酶突變體,BD5031及BD5064表現出高活性但並不耐酸或者耐高溫,BD5063耐酸耐高溫但是活性很低。印度Priyadharshini對部分地衣芽孢桿菌耐高溫α-澱粉酶胺基酸序列進行隨機突變,獲得一個pH適用範圍變寬的突變體I57S/W193R,但其催化活性及耐熱性能均顯著降低。
在中國,20世紀90年代中科院微生物研究所研究了嗜熱真菌Thermomyces lanuginosus所產的α-澱粉酶,該酶的最適溫度和pH分別為65攝氏度和5.0,但其耐熱性較差。商品化套用的真菌Aspergillus oryzae和Aspergillus awamori所產α-澱粉酶pH範圍為5.0-6.0,但不耐高溫。江南大學從澱粉加工廠的酸性土壤中篩選到的Bacillus stearothermopilius,能夠產生兩種酸性α-澱粉酶,最適pH分別為4.5和5.0,最適溫度為60攝氏度,可以套用於一定條件下酒糟利用和處理。
α-澱粉酶難以兼顧耐高溫、耐酸性及高活力的特性,因此不能適應中國製糖、釀造、有機酸等以澱粉為原料的深加工工業的要求。為了適應整個澱粉加工行業的需要,滿足一些在酸性條件下以澱粉為原料液化工藝的要求,應開發一種在高溫、低pH值下活力穩定的耐酸性高溫α-澱粉酶。
發明內容
專利目的
《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》的目的在於克服專利背景中相關技術的不足之處,提供一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法,該發明製備獲得的該耐酸性高溫α-澱粉酶具有良好的酸穩定性,在pH4.5,90攝氏度下保溫60分鐘殘餘活力仍保持在40%以上。
技術方案
一種耐酸性高溫α-澱粉酶基因,其基因序列為序列8。
一種耐酸性高溫α-澱粉酶基因的構建方法,方法為:將耐高溫α-澱粉酶基因進行定點突變,第1058位鹼基C→T,第1199位鹼基A→G,得到耐酸性高溫α-澱粉酶基因;所述耐高溫α-澱粉酶基因見序列7。
一種耐酸性高溫α-澱粉酶工程菌,含有如權利要求1所述的耐酸性高溫α-澱粉酶基因。
而且,所述工程菌的宿主細胞為枯草芽孢桿菌或地衣芽孢桿菌。
而且,所述工程菌為6種胞外蛋白酶缺失的枯草芽孢桿菌B.subtilis WB600。
而且,所述工程菌中的表達載體為大腸桿菌-芽孢桿菌穿梭質粒pBSA43。
一種耐酸性高溫α-澱粉酶,具有如權利要求1所述的基因編碼的蛋白序列。
而且,所述的α-澱粉酶在溫度90攝氏度,pH4.5下活力穩定。
一種耐酸性高溫α-澱粉酶的製備方法,其特徵在於:步驟如下:
(1)將耐高溫α-澱粉酶基因進行定點突變,第1058位鹼基C→T,第1199位鹼基A→G,得到耐酸性高溫α-澱粉酶基因;所述耐高溫α-澱粉酶基因見序列7;
(2)將上述耐酸性高溫α-澱粉酶基因與表達載體連線,構建獲得攜帶有耐酸性高溫α-澱粉酶基因的重組載體;
(3)將重組載體轉化入宿主菌株中,構建獲得重組菌株;
(4)重組菌株分泌表達,發酵製備耐酸性高溫α-澱粉酶。
而且,所述步驟⑵中的表達載體為大腸桿菌-芽孢桿菌穿梭質粒pBSA43。
改善效果
1、《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》利用重疊PCR技術,對耐高溫α-澱粉酶基因進行定點突變,獲得耐酸性高溫α-澱粉酶基因(T353I/H400R),並通過分泌型表達載體,轉化枯草芽孢桿菌,使耐酸性高溫α-澱粉酶得以表達,製備獲得的該耐酸性高溫α-澱粉酶具有良好的酸穩定性,在pH4.5,90攝氏度下保溫60分鐘殘餘活力仍保持在40%以上。
2、《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》製備的酶適用於一些澱粉深加工行業,對提高澱粉加工原料利用率和產品質量、簡化工藝、降低消耗、減少環境污染具有顯著效果,不僅具有明顯的社會效益,也具有重要的經濟效益。
附圖說明
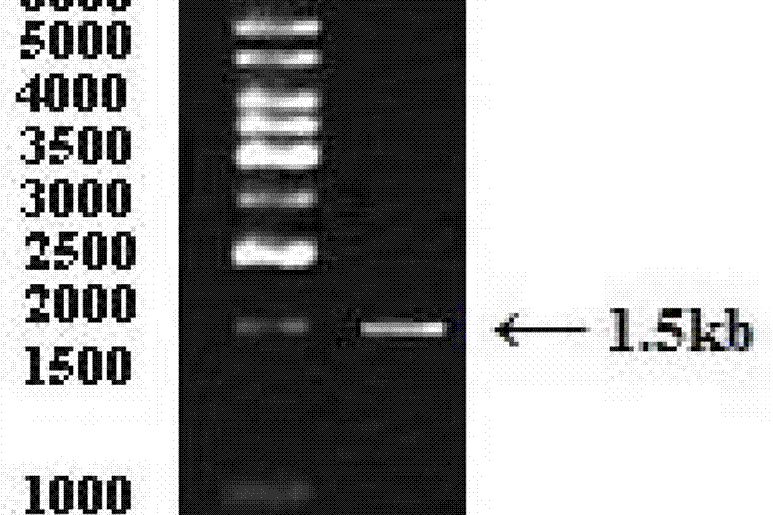
圖1為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》耐高溫α-澱粉酶的PCR擴增電泳圖,其中:1、DNA分子量標準,2、耐高溫α-澱粉酶基因片段;
圖2為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》重組質粒pUC-amy酶切驗證圖,其中:1、DNA分子量標準,2、pUC-amy經BamHI和HindIII雙酶切,3、pUC-amy經BamHI單酶切;
圖3為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》耐高溫α-澱粉酶的定點突變示意圖;
圖4為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》耐高溫α-澱粉酶(amy)與耐酸性高溫α-澱粉酶(amyd)基因序列比對突變位點示意圖;
圖5為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》重組載體pBSA43-amyd構建示意圖;
圖6為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》重組菌株分泌表達耐酸性高溫α-澱粉酶的聚丙烯醯胺凝膠電泳分析,其中:1、蛋白分子量標準,2、重組菌株WB600/pBSA43-amyd發酵上清液,3、對照菌株WB600/pBSA43發酵上清液;
圖7為《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》重組菌株分泌表達耐酸性高溫α-澱粉酶純化的聚丙烯醯胺凝膠電泳分析,其中:1、蛋白分子量標準,2、耐酸性高溫α-澱粉酶,3、耐高溫α-澱粉酶。
技術領域
《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》屬於生物工程領域,涉及基因的定點突變和重組DNA技術,尤其是一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法。
權利要求
1.一種耐酸性高溫α-澱粉酶工程菌,其特徵在於:含有基因序列為序列8的耐酸性高溫α-澱粉酶基因;所述工程菌的宿主細胞為枯草芽孢桿菌;所述枯草芽孢桿菌為B.subtilisWB600;所述工程菌中的表達載體為大腸桿菌-芽孢桿菌穿梭質粒pBSA43;所述pBSA43載體為以穿梭載體pBE2為骨架,克隆入一個芽孢桿菌組成型啟動子P43以及果聚糖蔗糖酶的信號序列sacB獲得。
2.一種如權利要求1所述的耐酸性高溫α-澱粉酶工程菌構建方法,其特徵在於:步驟如下:(1)將耐高溫α-澱粉酶基因進行定點突變,第1058位鹼基C→T,第1199位鹼基A→G,得到耐酸性高溫α-澱粉酶基因;所述耐高溫α-澱粉酶基因見序列7;(2)將上述耐酸性高溫α-澱粉酶基因與表達載體連線,構建獲得攜帶有耐酸性高溫α-澱粉酶基因的重組載體;(3)將重組載體轉化入宿主菌株中,構建獲得重組菌株;(4)重組菌株分泌表達,發酵製備耐酸性高溫α-澱粉酶。
實施方式
《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》利用定點突變技術對地衣芽孢桿菌耐高溫α-澱粉酶基因進行定向改造獲得耐酸性高溫α-澱粉酶基因,具體為利用重疊PCR技術對耐高溫α-澱粉酶基因進行定點突變,第1058位鹼基C→T,第1199位鹼基A→G,得到耐酸性高溫α-澱粉酶基因,再克隆到大腸桿菌-芽孢桿菌穿梭表達分泌表達型載體pBSA43,轉化6種胞外蛋白酶缺失的枯草芽孢桿菌WB600,實現耐酸性高溫α-澱粉酶分泌表達,成功製備獲得一種耐酸性高溫α-澱粉酶。
其中,pBSA43是大腸桿菌-芽孢桿菌穿梭分泌表達型載體,含有一個強啟動子P43啟動突變基因的轉錄,一個編碼果聚糖蔗糖酶基因sacB的信號肽用於指導合成α-澱粉酶分泌到胞外,適於在枯草芽孢桿菌、地衣芽孢桿菌中表達蛋白。
一、耐高溫α-澱粉酶基因(amy)的擴增
提取地衣芽孢桿菌基因組,地衣芽孢桿菌在中國工業微生物菌種保藏管理中心CICC保藏,保藏號:CICC10181。設計如下引物:
上游引物F1:(5’-CGCGGATCCGGCAAATCTTAATGGGACGCT-3’),
下游引物R1:(5’-CCCAAGCTTCTATCTTTGAACATAAATTGAAACC-3’),
其中上游引物F15’端引入BamHI酶切位點(下劃線部分),下游引物R15’端引入HindIII酶切位點(下劃線部分)。以地衣芽孢桿菌基因組為模板,進行PCR,按以下次序,將各成分在滅菌薄壁離心管內混合,反應體系為:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,上游引物F1(20微摩爾/升)2微升,下游引物R1(20微摩爾/升)2微升,DNA模版1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
擴增條件為:95攝氏度5分鐘,1個循環;94攝氏度30秒,53攝氏度30秒,72攝氏度1分鐘,30個循環;最後一個循環為72攝氏度10分鐘。
PCR產物經瓊脂糖凝膠電泳檢測在約1.5千鹼基對處出現特異性條帶,其大小與目的基因amy片段大小完全吻合。
將擴增得到的目的基因amy與pUC19(購自TAKARA公司)分別用BamHI和HindIII雙酶切,經純化後,通過連線試劑盒(購自TAKARA公司)在16攝氏度連線12小時,構建重組質粒pUC-amy。
將10微升的pUC-amy電轉化40微升大腸桿菌JM109感受態細胞,塗布在含氨苄青黴素(100微克/毫升)的IPTG、X-gal的LA(LB:胰蛋白腖1%,酵母抽提物0.5%,氯化鈉1%;瓊脂粉2%)平板上,從藍白選擇平板上挑選驗證正確的陽性轉化子pUC-amy。測序(委託上海生工生物工程公司)結果表明擴增獲得耐高溫α-澱粉酶基因amy。
二、耐高溫α-澱粉酶基因的定點突變
設計如下引物(委託上海英俊生物技術有限公司合成):
重疊引物A:5’-TACGCTTTTATTCTCATAAGGGAATCT-3’
重疊引物B:5’-AGATTCCCTTATGAGAATAAAAGCGTA-3’
重疊引物C:5’-GGAGCACAGCGTGATTATTTCGACCA-3’
重疊引物D:5’-TGGTCGAAATAATCACGCTGTGCTCC-3’
重疊引物A與B中包含了對1058位核苷酸的突變(C→T),使其編碼的353位胺基酸由蘇氨酸突變為異亮氨酸,重疊引物C與D中包含了對1199位核苷酸的突變(A→G),使其編碼的400位胺基酸由組氨酸突變成精氨酸。
以重組質粒pUC-amy為模板進行PCR擴增,按照如下順序,將各組分在PCR管內混合;
PCR1,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,上游引物F1(20微摩爾/升)2微升,重疊引物B(20微摩爾/升)2微升,DNA模板(pUC-amy)1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR2,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,重疊引物A(20微摩爾/升)2微升,下游引物R1(20微摩爾/升)2微升,DNA模板(pUC-amy)1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;95攝氏度30秒,58攝氏度30秒,72攝氏度1分鐘,30個循環;72攝氏度10分鐘。接著進行第二步的PCR,按照如下順序,將各組分在PCR管內混合;
PCR3,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,PCR1產物1微升,PCR2產物1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O40.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;1個循環;95攝氏度30秒,58攝氏度30秒,72攝氏度10分鐘,10個循環;72攝氏度5分鐘1個循環。
PCR4,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,上游引物F1(20微摩爾/升)2微升,下游引物R1(20微摩爾/升)2微升,PCR3產物1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;1個循環;95攝氏度30秒,58攝氏度30秒,72攝氏度1分鐘,25個循環;72攝氏度10分鐘1個循環。
測序(委託上海生工生物工程公司)結果表明此時擴增得到的是對第1058位核苷酸突變(C→T)的基因片段amy1,以此基因為DNA模版進行下一輪PCR。
PCR5,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,上游引物F1(20微摩爾/升)2微升,重疊引物D(20微摩爾/升)2微升,DNA模板(amy1)1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR6,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,重疊引物C(20微摩爾/升)2微升,下游引物R1(20微摩爾/升)2微升,DNA模板(amy1)1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;95攝氏度30秒,58攝氏度30秒,72攝氏度1分鐘,30個循環;72攝氏度10分鐘。接著進行第二步的PCR,按照如下順序,將各組分在PCR管內混合;
PCR7,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)4微升,PCR5產物1微升,PCR6產物2微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;1個循環;95攝氏度30秒,58攝氏度30秒,72攝氏度10分鐘,10個循環;72攝氏度5分鐘1個循環。
PCR8,反應體系如下:10×buffer5微升,dNTPs(2.5毫摩爾/升 each)2微升,上游引物F1(20微摩爾/升)2微升,下游引物R1(20微摩爾/升)2微升,PCR7產物1微升,Pyrobest高保真DNA聚合酶0.5微升,ddH2O37.5微升,總體積50微升。
PCR擴增程式:95攝氏度5分鐘;1個循環;95攝氏度30秒,58攝氏度30秒,72攝氏度1分鐘,25個循環;72攝氏度10分鐘1個循環。
測序(委託上海生工生物工程公司)結果表明此時擴增得到的是對第1058位核苷酸突變(C→T)和對第1199位核苷酸突變(A→G)的基因片段amyd。
三、耐酸性高溫α-澱粉酶表達載體pBSA43-amyd的構建
pBSA43為以大腸桿菌-枯草芽孢桿菌穿梭克隆載體pBE2為骨架,克隆入一個強的芽孢桿菌組成型啟動子P43及能夠使重組蛋白直接分泌到培養基中的果聚糖蔗糖酶信號序列sacB而獲得。它同時含有枯草桿菌質粒pUB110的複製子和大腸桿菌質粒pGEM3的複製子,既能在大腸桿菌又能在枯草芽孢桿菌、地衣芽孢桿菌細胞中進行自主複製。它帶有Amp基因,可以在大腸桿菌中利用氨苄青黴素抗性作為篩選標記。同時又帶有Km,可以在枯草芽孢桿菌、地衣芽孢桿菌中利用卡那黴素抗性作為篩選標記。
將經重疊PCR構建獲得的耐酸性高溫α-澱粉酶基因amyd與pBSA43分別用BamHI、HindIII雙酶切,經純化後,通過連線試劑盒(購自TAKARA公司)在16攝氏度連線12小時,構建重組質粒pBSA43-amyd。將10微升的pBSA43-amyd電轉化40微升大腸桿菌JM109感受態細胞,塗布在含氨苄青黴素(100微克/毫升)的LA平板上,挑選陽性轉化子,提取質粒進行酶切驗證,確定構建獲得重組菌株JM109/pBSA43-amyd。
四、表達載體pBSA43-amyd轉化枯草芽孢桿菌WB600
按下述方法製備枯草芽孢桿菌WB600(實驗室保存)的感受態細胞。挑取一環孢子接種於少量生長培養基(LB+0.5摩爾/升山梨醇)中,過夜培養。將種子以1/16的接種量接種於生長培養基(LB+0.5摩爾/升山梨醇)中,37攝氏度搖床震盪培養至OD600在0.85-0.95左右。冰水浴冷卻培養物10分鐘,於4攝氏度,5000轉/分鐘,離心5分鐘收集菌體。反覆用冰冷的電擊緩衝液(0.5摩爾/升山梨醇,0.5摩爾/升甘露醇,10%體積分數甘油)洗滌細胞收集物4次。用原培養液1/40體積的電擊緩衝液重新懸浮細胞收集物,細胞濃度應該在1-1.3×10菌群/毫升。感受態細胞分裝為60微升/EP管保存在-80攝氏度(不需要液氮預凍),在轉化效率有所下降之前都可以正常使用。轉化條件:60微升感受態細胞加入1微升(50納克/微升)pBSA43-amyd混勻並轉移到冰冷的電轉化杯(1毫米)中,冰浴1-1.5分鐘後,電擊一次(25微法,200歐姆,4.5-5.0毫秒)。電擊完畢之後,立即加入1毫升復甦培養基(LB+0.5摩爾/升山梨醇+0.38摩爾/升甘露醇)。37攝氏度搖床震盪培養3小時之後,將復甦物塗布在LB平板上,37攝氏度培養24-36小時,挑取陽性轉化子,獲得枯草芽孢桿菌重組菌株WB600/pBSA43-amyd。
五、耐酸性高溫α-澱粉酶在枯草芽孢桿菌重組菌株中的表達及純化耐酸性高溫α-澱粉酶
將枯草芽孢桿菌重組菌株WB600/pBSA43-amyd接種於LB液體培養基(含卡納黴素,30微克/毫升)中,37攝氏度,200轉/分鐘培養過夜,按1%接種量轉接於50毫升新鮮培養基中,200轉/分鐘培養24小時,由於表達載體pBSA43為枯草芽孢桿菌組成型表達載體,不需額外加誘導劑誘導,培養24小時後,即可製備獲得耐酸性高溫α-澱粉酶粗酶液。直接取樣進行SDS-PAGE及活性檢測。
純化耐酸性高溫α-澱粉酶的步驟如下:採用分級鹽析法,先以30%飽和度的硫酸銨鹽析除去雜蛋白,再把飽和度加大到70%,沉澱α-澱粉酶,收集30%-70%範圍內蛋白質沉澱部分,溶解後,透析除鹽。然後使用弱陰離子交換劑DEAE-Sepharose Fast Flow對硫酸銨鹽析得到的活性組分進行分離(2毫升上樣量,上樣後用0.02摩爾/升Tris-HCl(pH7.0)洗脫未吸附的蛋白,3毫升/管分部收集,第51管開始梯度洗脫,緩衝液為0-1.0摩爾/升NaCl的0.02摩爾/升Tris-HCl(pH7.0),流速1.5毫升/分鐘,3毫升/管分步收集),經DEAE-Sepharose Fast Flow離子交換後獲得的活性組分再用Sephadex G-75凝膠過濾(2毫升上樣量,上樣後用含0.15摩爾/升NaCl的0.02摩爾/升Tris-HCl(pH7.0)洗脫,流速0.5毫升/分鐘,2毫升/管分部收集),製備獲得電泳純的耐酸性高溫α-澱粉酶。
六、產品性能測定
1.α-澱粉酶活力的測定
將枯草芽孢桿菌重組菌株WB600/pBSA43-amyd發酵液,12000轉/分鐘離心10分鐘去除細胞,測定上清液中的酶活(記為細胞外酶活)。酶活力單位定義:在70攝氏度、相應pH條件下,1分鐘液化1毫克可溶性澱粉成為糊精所需要的酶量,即為1個酶活力單位,以單位/毫升(單位/克)表示。測定方法如下:1.酶液製備:用緩衝液配製成酶溶液,使其最終酶濃度控制在65單位/毫升-70單位/毫升範圍之內。2.測定:(1)吸取可溶性澱粉溶液(20g/L)20毫升和磷酸緩衝液(相應pH)5毫升於試管中。在70攝氏度恆溫水浴中預熱3分鐘-5分鐘。(2)加入稀釋好的待測酶液1.00毫升,立即計時,搖勻,準確反應5分鐘。(3)立即吸取1.00毫升反應液移入預先裝有0.1摩爾/升HCl0.5毫升和5毫升稀碘液的試管中搖勻。(4)以0.1摩爾/升HCl0.5毫升和5毫升稀碘液的混合液作空白,於660納米波長下,用10毫米比色皿迅速測定吸光度(A)。根據吸光度查表,求得測試酶液的濃度(C)。3.計算:X=C×N×16.67式中:X-樣品的酶活力單位/毫升(單位/克);C-測試的酶液濃度單位/毫升;N-樣品的稀釋倍數;16.67-換算常數。所得結果表示至整數。
pH | 耐酸性高溫α-澱粉酶活力(單位/毫升) | 耐高溫α-澱粉酶活力(單位/毫升) |
|---|---|---|
4.0 | 1120 | 130 |
4.5 | 1470 | 220 |
5.0 | 1860 | 450 |
5.5 | 2170 | 1130 |
6.0 | 1770 | 1810 |
6.5 | 1520 | 2160 |
7.0 | 1490 | 1930 |
如表1所示,在高溫條件70攝氏度、酸性環境pH4.0-5.5之間時,耐酸性高溫α-澱粉酶活力明顯高於耐高溫α-澱粉酶活力,說明製備獲得的耐酸性高溫α-澱粉酶在酸性條件下活力明顯得到提高。
2.耐酸性高溫α-澱粉酶性質的研究
經硫酸銨鹽析、DEAE-Sepharose Fast Flow離子交換層析、Sephadex G-75凝膠層析分離純化後,得到電泳純的耐酸性高溫α-澱粉酶,以原始耐高溫α-澱粉酶為對照,對其進行酶學性質研究。
(1)溫度對酶活力的影響
最適反應溫度的測定:在不同溫度(60攝氏度、70攝氏度、80攝氏度、90攝氏度、95攝氏度、100攝氏度),pH6.0的條件下測定重組酶純化酶液的酶活,將最高活力定為100%。
熱穩定性的測定:將重組酶純化酶液在90攝氏度,pH6.0下保溫2小時,每隔20分鐘取出,於冰上迅速冷卻,各自測定其殘餘酶活力,以未保溫的酶液活力為100%。
(2)pH對酶活力的影響酶
最適反應pH的測定:在不同pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0),70攝氏度下測定重組酶純化酶液的酶活,將最高活力定為100%。
pH穩定性的測定:將重組酶純化酶液在pH4.5下,90攝氏度保溫60分鐘,每隔10分鐘取出,於冰上迅速冷卻,各自測定其殘餘酶活力,以未保溫的酶活力為100%。
重組酶性質的分析:通過研究可知,耐酸性高溫α-澱粉酶和耐高溫α-澱粉酶最適作用溫度均為95攝氏度;於pH6.0下,90攝氏度保溫60分鐘,耐酸性高溫α-澱粉酶和耐高溫α-澱粉酶殘餘酶活力均為80%左右,說明突變位點並沒有影響突變酶的耐高溫性能。耐酸性高溫α-澱粉酶最適作用pH為5.5,耐高溫α-澱粉酶最適作用pH為6.5;於pH4.5下,90攝氏度保溫60分鐘,耐酸性高溫α-澱粉酶殘餘酶活力為40%,於pH4.5下,90攝氏度保溫10分鐘,耐高溫α-澱粉酶殘餘酶活力僅為27%,保溫40分鐘後完全失活,說明突變位點顯著提高了突變酶的耐酸性能。
由此說明,耐高溫α-澱粉酶由原353位的L-蘇氨酸變為L-異亮氨酸(ACA→ATA),原400位的L-絲氨酸變為L-丙氨酸(CAT→CGT)後,可提高耐高溫α-澱粉酶在酸性環境中的穩定性,說明耐高溫α-澱粉酶基因經定點突變後,構建獲得耐酸性高溫α-澱粉酶基因,經克隆到大腸桿菌-芽孢桿菌穿梭表達分泌表達型載體pBSA43,轉化6種胞外蛋白酶缺失的枯草芽孢桿菌WB600,實現耐酸性高溫α-澱粉酶分泌表達,成功製備獲得一種耐酸性高溫α-澱粉酶。
專利榮譽
2021年6月24日,《一種耐酸性高溫α-澱粉酶及其基因、工程菌和製備方法》獲得第二十二屆中國專利優秀獎。