專利背景 禽流感 (Avian Influenza,AI),是由流感病毒屬的A型流感病毒引起的禽類感染和疾病的總稱。雞、火雞、鴨和鵪鶉等家禽及野鳥、水禽、海鳥等均可感染,而對家養的雞和火雞引起的危害最為嚴重,候鳥、觀賞鳥、散禽攜帶病毒遷徙可能是禽流感世界性流行的主要原因,豬等也可作為“混合器”傳播本病。
根據禽流感病毒AIV對禽類致病性的差異,可將AIV分為高致病性禽流感病毒(HPAIV)和低致病性禽流感病毒(LPAIV)。截至2013年11月8日,H9亞型禽流感屬於低致病性流感病毒,是中國雞群中存在的AIV主要亞型,該病毒發病後雖然致死率不高(一般不超過30%),但常導致呼吸道症狀,蛋雞的產蛋下降,並使雞群易繼發嚴重的呼吸道疾病,影響家禽生產性能。其流行特點是:H9亞型仍是當前流行的主要亞型;H9亞型已發生變異;H9亞型成散發或地方性流行;H9亞型呈現出條件性致病的特性;H9亞型對肉仔雞危害日益嚴重。
AIV遺傳變異極為頻繁,血清亞型眾多。研究發現,AIV可通過基於的點突變、基因重組和節段重排而發生不同程度的變異,從而使流感病毒的抗原性和致病性發生改變。AIV的變異主要發生在HA和NA基因上,尤其是HA基因,其分子機理主要有:抗原漂移、抗原轉變、RNA重組和缺損性病毒顆粒的產生等。近些年,隨著反向遺傳學的發展,禽流感遺傳變異和其機制逐步得到證實。就H5亞型而言,根據當前H5亞型的變異情況,採用反向遺傳技術獲得了Rec-1、Rec-4、Rec-5和Rec-6疫苗株,在高致病性禽流感的防控方面取得了一定的成績。關於H9亞型的變異研究也一直在進行中。劉岩對1998-2002年間分離的H9亞型禽流感病毒的抗原性變異進行了研究,經交叉HI試驗、雞胚中和試驗、細胞中和試驗、交叉攻毒保護試驗及HA基因分析,證明了H9亞型禽流感病毒已經發生了抗原性漂移。而姜北宇等人的研究則表明,1998-2008年在北京及河北省分離的4株H9亞型禽流感流行毒株間大多產生了較好的交叉保護力,用1998-2006年分離的流行毒株製備的滅活疫苗能夠保護2008年流行毒株的攻擊。可見,對於H9亞型禽流感病毒流行毒株抗原性是否發生變異的問題,不同報導得出的試驗結論存在較大的差異。
截至2013年11月8日,疫苗免疫仍是防控H9亞型禽流感有效辦法之一。隨著H9亞型禽流感滅活疫苗單苗或者聯苗的廣泛套用,在免疫壓力的作用下,開始出現以前使用的疫苗毒株對現地分離毒株的免疫保護力下降,許多養殖單位根據自身免疫需要紛紛採用現地流行毒株製成滅活疫苗來防控H9亞型禽流感的發生,但這些疫苗不能正規生產、銷售和大面積推廣,並且不能保證其安全性。因此,針對疫病現在的流行特點,重新篩選安全、有效、穩定的禽流感H9亞型病毒株製備H9亞型滅活疫苗顯得非常必要。
發明內容 專利目的 《一種禽流感H9亞型滅活疫苗及其製備方法和套用》的目的在於提供一種利用2株不同地方分離的H9亞型禽流感毒株製備成一種免疫原性強、交叉保護性好的滅活疫苗,用於預防雞H9亞型禽流感。
技術方案 《一種禽流感H9亞型滅活疫苗及其製備方法和套用》所採用的技術方案如下:
一種禽流感H9亞型滅活疫苗,由2株H9亞型禽流感病毒經滅活後和油佐劑混合組成,2株H9亞型禽流感病毒分別為HZ株和FJ株,其保藏登記號分別為CGMCCNO.8355和CGMCCNO.8354;HZ株的HA基因序列如SEQIDNO:1所示,FJ株的HA基因序列如SEQIDNO:2所示。HZ株和FJ株於2013年10月15日提交中國微生物菌種保藏管理委員會普通微生物中心保藏,該中心於2013年10月18日收到上述保藏菌株,保藏日期為2013年10月18日,該中心地址為北京市朝陽區北辰西路1號院3號。
一種禽流感H9亞型滅活疫苗的製備方法,其特徵在於包括如下步驟:
1)製備H9亞型禽流感病毒HZ株毒液:將H9亞型禽流感病毒HZ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒HZ株毒液;
2)製備H9亞型禽流感病毒FJ株毒液:將H9亞型禽流感病毒FJ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒FJ株毒液;
3)滅活H9亞型禽流感病毒HZ株毒液:在HZ株毒液中加入終濃度為0.2%甲醛溶液,37℃搖床滅活24小時;
4)滅活H9亞型禽流感病毒FJ株毒液:在FJ株毒液中加入終濃度為0.1%甲醛溶液,37℃搖床滅活24小時;
5)製備油相溶液:將白油和司本-80按照體積比為18~20:1混合均勻,加熱溶解後經121℃滅菌20分鐘;
6)製備水相溶液:將滅活的HZ株毒液和滅活的FJ株毒液按照體積比為6:4混合均勻,加入占混合毒液體積比0.75%的高壓滅菌的吐溫-80,用磁力攪拌器混勻攪拌至吐溫完全溶解;
7)乳化:將油相溶液和水相溶液按照體積比為1~2:1混合均勻,在乳化攪拌機中攪拌,即製成所述禽流感H9亞型滅活疫苗。
作為《一種禽流感H9亞型滅活疫苗及其製備方法和套用》的進一步技術方案,步驟5)中的白油和司本-80按照體積比為18.5:1混合。
作為《一種禽流感H9亞型滅活疫苗及其製備方法和套用》的進一步技術方案,步驟7)中的油相溶液和水相溶液按照體積比為1.5:1混合。
一種禽流感H9亞型滅活疫苗在預防雞禽流感疾病中的套用。
有益效果 利用2株不同地方分離的H9亞型禽流感毒株製備成一種免疫原性強、交叉保護性好的滅活疫苗,用於預防雞H9亞型禽流感。該疫苗接種雞後,抗體效價高,使得雞對不同地方流行的H9亞型毒株攻毒保護力好,並且安全性高、效力穩定。
附圖說明 圖1為黃雞免疫HZ-FJ株滅活疫苗後的禽流感H9亞型血清抗體水平變化;
圖2為竹絲雞免疫HZ-FJ株滅活疫苗後禽流感H9亞型血清抗體水平變化。
技術領域 《一種禽流感H9亞型滅活疫苗及其製備方法和套用》屬於動物用生物製品技術領域,具體涉及一種禽流感H9亞型滅活疫苗及其製備方法和套用。
權利要求 1.一種禽流感H9亞型滅活疫苗,其特徵在於:由2株H9亞型禽流感病毒經滅活後和油佐劑混合組成,2株H9亞型禽流感病毒分別為HZ株和FJ株,其保藏登記號分別為CGMCC:8355和CGMCC:8354,HZ株的HA基因序列如SEQIDNO:1所示,FJ株的HA基因序列如SEQIDNO:2所示。
2.一種權利要求1所述的禽流感H9亞型滅活疫苗的製備方法,其特徵在於包括如下步驟:
1)製備H9亞型禽流感病毒HZ株毒液:將H9亞型禽流感病毒HZ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒HZ株毒液;
2)製備H9亞型禽流感病毒FJ株毒液:將H9亞型禽流感病毒FJ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒FJ株毒液;
3)滅活H9亞型禽流感病毒HZ株毒液:在HZ株毒液中加入終濃度為0.2%甲醛溶液,37℃搖床滅活24小時;
4)滅活H9亞型禽流感病毒FJ株毒液:在FJ株毒液中加入終濃度為0.1%甲醛溶液,37℃搖床滅活24小時;
5)製備油相溶液:將白油和司本-80按照體積比為18~20:1混合均勻,加熱溶解後經121℃滅菌20分鐘;
6)製備水相溶液:將滅活的HZ株毒液和滅活的FJ株毒液按照體積比為6:4混合均勻,加入占混合毒液體積比0.75%的高壓滅菌的吐溫-80,用磁力攪拌器混勻攪拌至吐溫完全溶解;
7)乳化:將油相溶液和水相溶液按照體積比為1~2:1混合均勻,在乳化攪拌機中攪拌,即製成所述禽流感H9亞型滅活疫苗。
3.根據權利要求2所述的一種禽流感H9亞型滅活疫苗的製備方法,其特徵在於:步驟5)中的白油和司本-80按照體積比為18.5:1混合。
4.根據權利要求2所述的一種禽流感H9亞型滅活疫苗的製備方法,其特徵在於:步驟7)中的油相溶液和水相溶液按照體積比為1.5:1混合。
5.一種如權利要求1所述的禽流感H9亞型滅活疫苗在製備預防雞禽流感疾病的藥物中的套用。
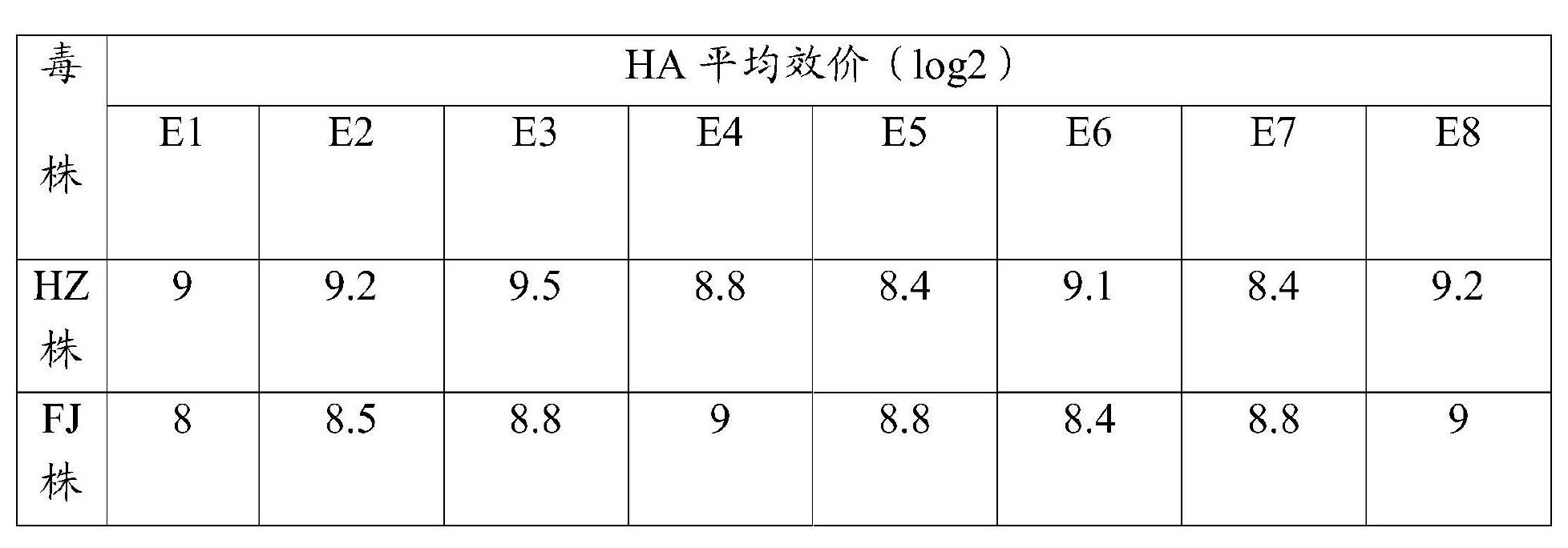
實施方式 《一種禽流感H9亞型滅活疫苗及其製備方法和套用》所述的H9亞型禽流感病毒HZ株和FJ株分別是2010年在我國浙江湖州地區和福建莆田地區發病雞場的發病雞群採集的病料中分離到的,經測序鑑定,都為禽流感病毒H9亞型。其生物學特性研究如下:1)毒種傳代:HZ株、FJ株原代種毒(E1代)用滅菌生理鹽水稀釋至10-4,經尿囊腔內接種9日齡SPF雞胚,每胚0.2毫升,於37℃繼續孵育96小時,收穫24~96小時內死亡及存活的雞胚,凍存過夜後逐個收穫雞胚液並檢測其HA效價,將檢驗無菌且HA效價≥8log2的雞胚液混合,定量分裝,註明收穫日期、毒種代次等,標記為E2代,留取少量繼續傳代,其餘的置-70℃保存備用。按上述方法連續在SPF雞胚內傳代至第8代(E8代),每一代分別測定各胚的HA效價及其平均數,結果詳見表1。
表1 毒株E1~E8代的HA效價
試驗結果顯示,2株AIVH9亞型毒株在傳代過程中HA效價都相當穩定,HA效價平均值均保持在8log2以上,說明HZ株和FJ株均可在雞胚上穩定地複製傳代。
2)病毒特異性:按“中國獸藥典”HI試驗方法,HZ株、FJ株病毒液分別配製4單位抗原,然後用ND、EDS、AIVH5、AIVH7和AIVH9標準陽性血清進行HI試驗,結果詳見表2。
表2 毒株特異性試驗結果
註:《一種禽流感H9亞型滅活疫苗及其製備方法和套用》中的ND、EDS、AIVH5、AIVH7、AIVH9標準陽性血清和抗原購自中國獸藥監察所和哈爾濱獸醫研究所。
試驗結果顯示,HZ株和FJ株毒液凝集雞紅細胞的特性均能被H9亞型禽流感陽性血清特異性中和,不能被ND、EDS和AIVH7陽性血清中和;與AIVH5陽性血清有極微弱的反應,可以忽略;結果表明HZ株和FJ株病毒液均具有很強的病毒特異性。
3)病毒的免疫原性:(1)HZ株的免疫原性:將HZ株的E8代毒種分別製成油乳劑滅活疫苗,頸部皮下注射免疫21日齡SPF雞10隻,每隻0.3毫升,同時設條件相同的對照SPF雞5隻。免疫21日後,連同對照組採集雞血清檢測AIVH9亞型HI抗體,然後各靜脈注射HZ株病毒液0.2毫升(含2×106EID50)。攻毒後第5日,採集每隻雞喉頭棉拭子,分別尿囊腔內接種9~10日齡SPF雞胚5枚,每胚0.2毫升,37℃孵育96小時,檢測所有雞胚液HA效價。每個棉拭子樣品接種的雞胚中,只要有1枚雞胚的HA效價≥4log2,即可判為病毒分離陽性,對病毒分離陰性的樣品,盲傳一代後再進行判定,結果詳見表3。
表3 HZ株病毒的免疫攻毒試驗結果
試驗結果顯示,免疫雞的HI抗體幾何平均值為9log2,而對照雞HI抗體均為0;攻毒後,免疫組雞病毒分離陰性率為9/10,而對照組雞病毒分離陰性率為0/5;表明HZ株具有很好的免疫原性。
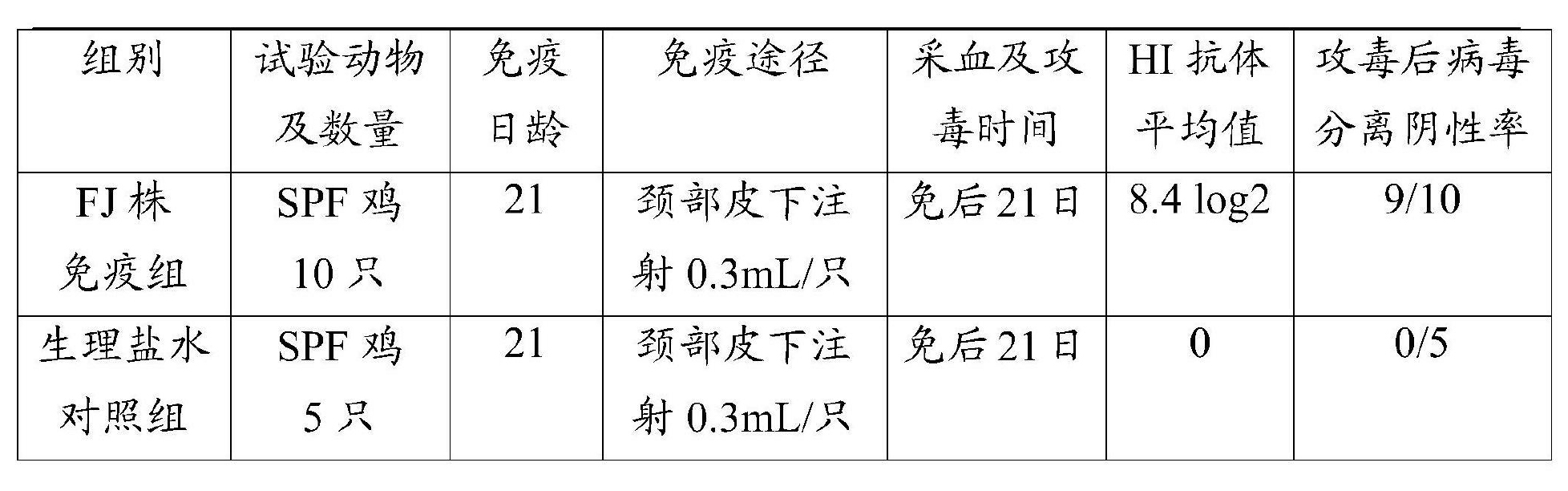
(2)FJ株的免疫原性:檢測方法同HZ株的檢測方法,結果詳見表4。
表4 FJ株病毒的免疫攻毒試驗結果
試驗結果顯示,免疫雞的HI抗體幾何平均值為8.4log2,而對照雞HI抗體均為0;攻毒後,免疫組雞病毒分離陰性率為9/10,而對照組雞病毒分離陰性率為0/5;表明FJ株具有較好的免疫原性。
4)病毒HA基因的序列分析:參考已發表的H9亞型AIV序列資料,設計併合成了AIVHA基因的RT-PCR引物,成功擴增了HZ株和FJ株病毒的HA基因序列,得到HZ株的HA基因序列如SEQIDNO:1所示,FJ株的HA基因序列如SEQIDNO:2所示。
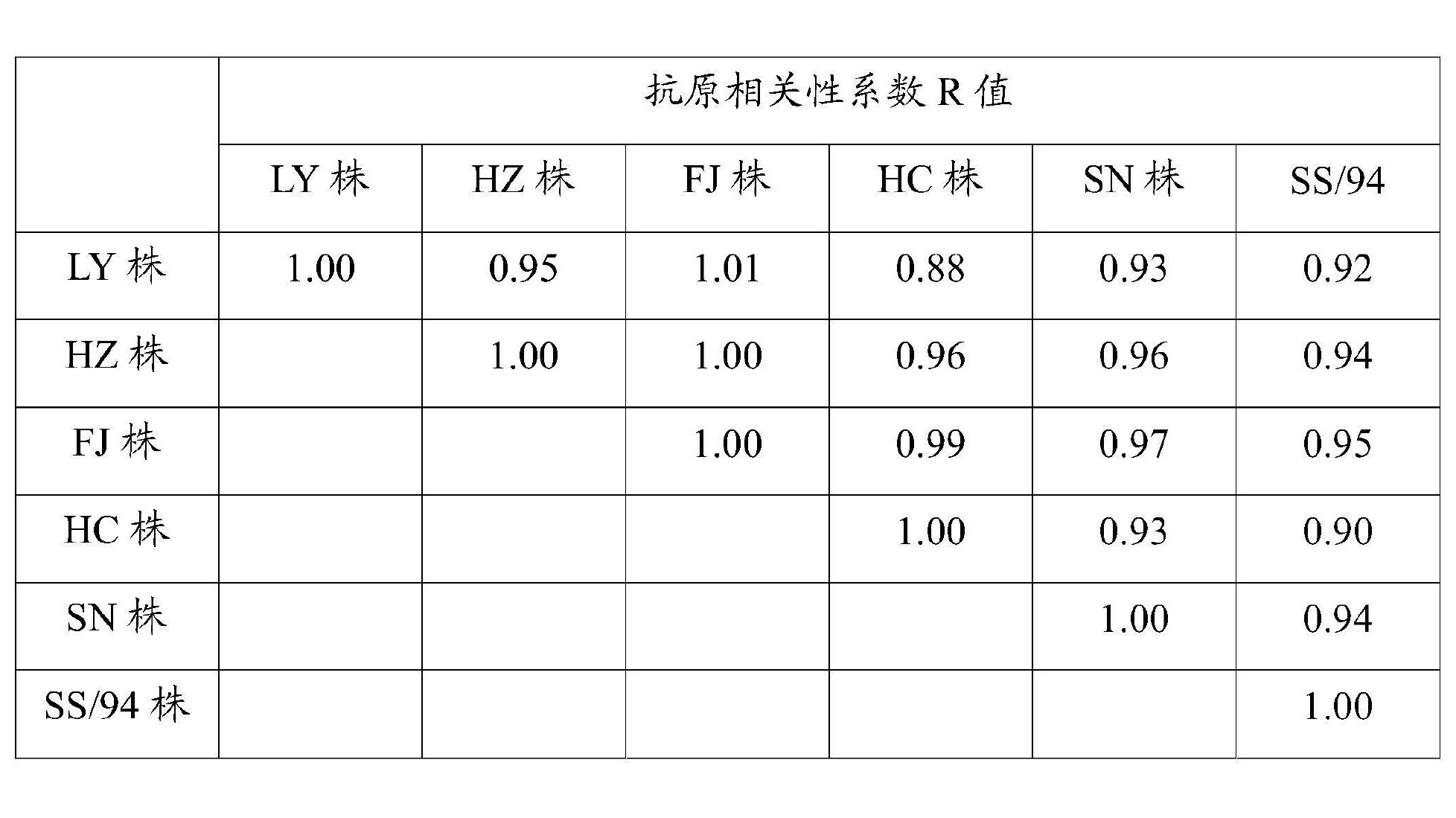
5)抗原相關性分析:將該實驗室保存的6株AIVH9亞型毒株,包括HZ株和FJ株,分別製備成油乳劑滅活疫苗,免疫21日齡SPF雞,在隔離飼養器內製備單因子血清,用於交叉HI試驗,檢測HZ株和FJ株病毒的抗原譜是否廣譜。抗原相關性的判定標準如下:抗原間的相關性
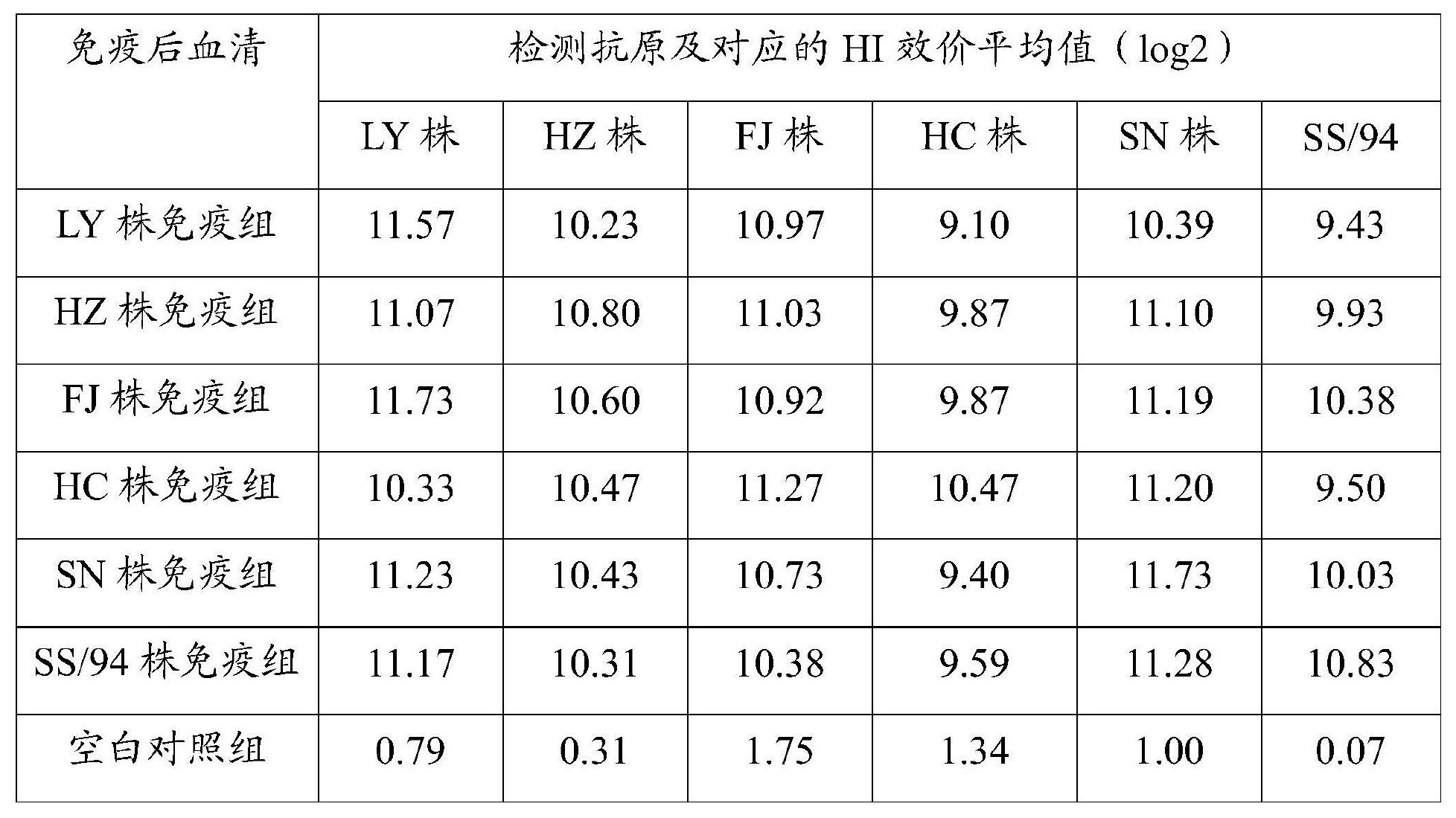
,R為2株病毒間的抗原性差異,r1為甲病毒對乙血清的HI滴度/甲病毒對甲血清的HI滴度,r2為乙病毒對甲血清的HI滴度/乙病毒對乙血清的HI滴度;如果R=1,表明兩個毒株間抗原性相同;如果0.67≤R≤1.5,表明兩個毒株間抗原性無明顯差異;如果0.5≤R<0.67,表明兩個毒株間抗原性有小的差異;如果R<0.5,表明兩個毒株間抗原性的差異明顯;R值越小,抗原性差異越大,結果詳見表5和表6。試驗結果顯示,HZ株與其餘5株AIVH9病毒的抗原相關性均大於0.94,表明該病毒與其餘毒株的抗原相關性很好;FJ株與其餘5株AIVH9病毒的抗原相關性均大於0.95,表明該病毒與其餘毒株的抗原相關性很好。
表5 6株病毒之間交叉血凝抑制試驗結果
表6 6株病毒之間抗原相關性
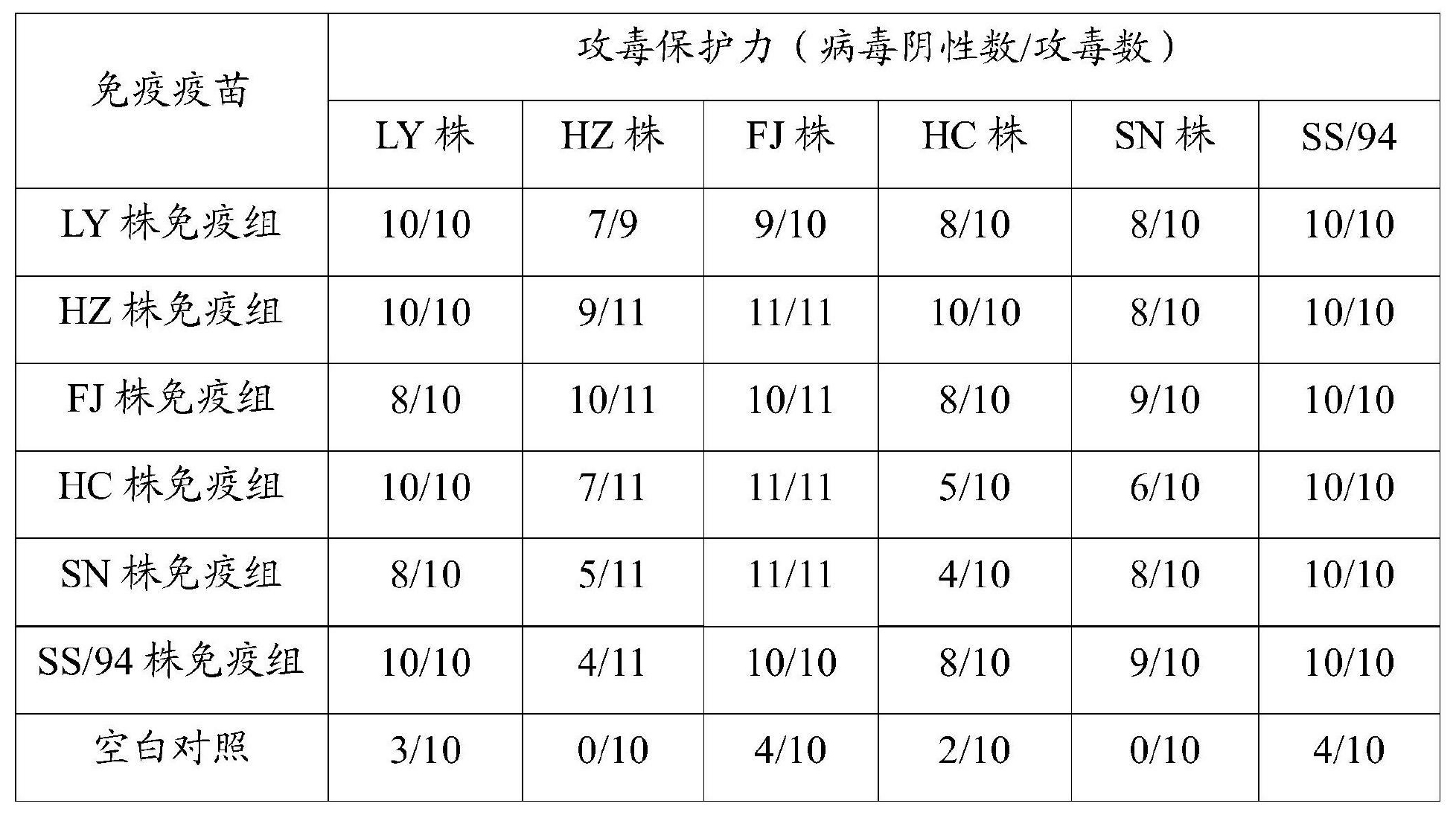
6)交叉攻毒保護試驗:HZ株和FJ株滅活疫苗免疫後21日,用6株AIVH9亞型毒株進行攻毒,攻毒後第5日採集雞喉頭棉拭子,分別尿囊腔內接種9~10日齡SPF雞胚進行病毒分離,檢測HZ株和FJ株對野毒攻擊能否產生較好的免疫保護效果,結果詳見表7。
表7 6株毒株之間交叉保護試驗
表7的攻毒試驗結果表明,HZ株的交叉保護性最好,除了對自身保護力為9/11和對SN株保護力為8/10以外,其對其餘4個毒株為全部保護;FJ株對不同毒株的交叉保護性亦較好,病毒陰性數/攻毒數均能達到8/10及以上,並且對HZ株、SN株的保護力分別可以達到10/11、9/10。
結合以上試驗數據,《一種禽流感H9亞型滅活疫苗及其製備方法和套用》選擇HZ株和FJ株相配合而製成禽流感H9亞型滅活疫苗。
一種禽流感H9亞型滅活疫苗的製備方法,其特徵在於包括如下步驟:
1)製備H9亞型禽流感病毒HZ株毒液:將H9亞型禽流感病毒HZ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒HZ株毒液;
2)製備H9亞型禽流感病毒FJ株毒液:將H9亞型禽流感病毒FJ株用生理鹽水作10-4稀釋,接種9~11日齡SPF雞胚,無菌收穫24~96小時內死亡及96小時後仍存活的HA≥8log2的雞胚尿囊液作為H9亞型禽流感病毒FJ株毒液;
3)滅活H9亞型禽流感病毒HZ株毒液:在HZ株毒液中加入終濃度為0.2%甲醛溶液,37℃搖床滅活24小時;
4)滅活H9亞型禽流感病毒FJ株毒液:在FJ株毒液中加入終濃度為0.1%甲醛溶液,37℃搖床滅活24小時;
5)製備油相溶液:將白油和司本-80按照體積比為18~20:1混合均勻,加熱溶解後經121℃滅菌20分鐘;
6)製備水相溶液:將滅活的HZ株毒液和滅活的FJ株毒液按照體積比為6:4混合均勻,加入占混合毒液體積比0.75%的高壓滅菌的吐溫-80,用磁力攪拌器混勻攪拌至吐溫完全溶解;
7)乳化:將油相溶液和水相溶液按照體積比為1~2:1混合均勻,在乳化攪拌機中以10000轉/分鐘的速率,攪拌10分鐘,即製成所述禽流感H9亞型滅活疫苗。
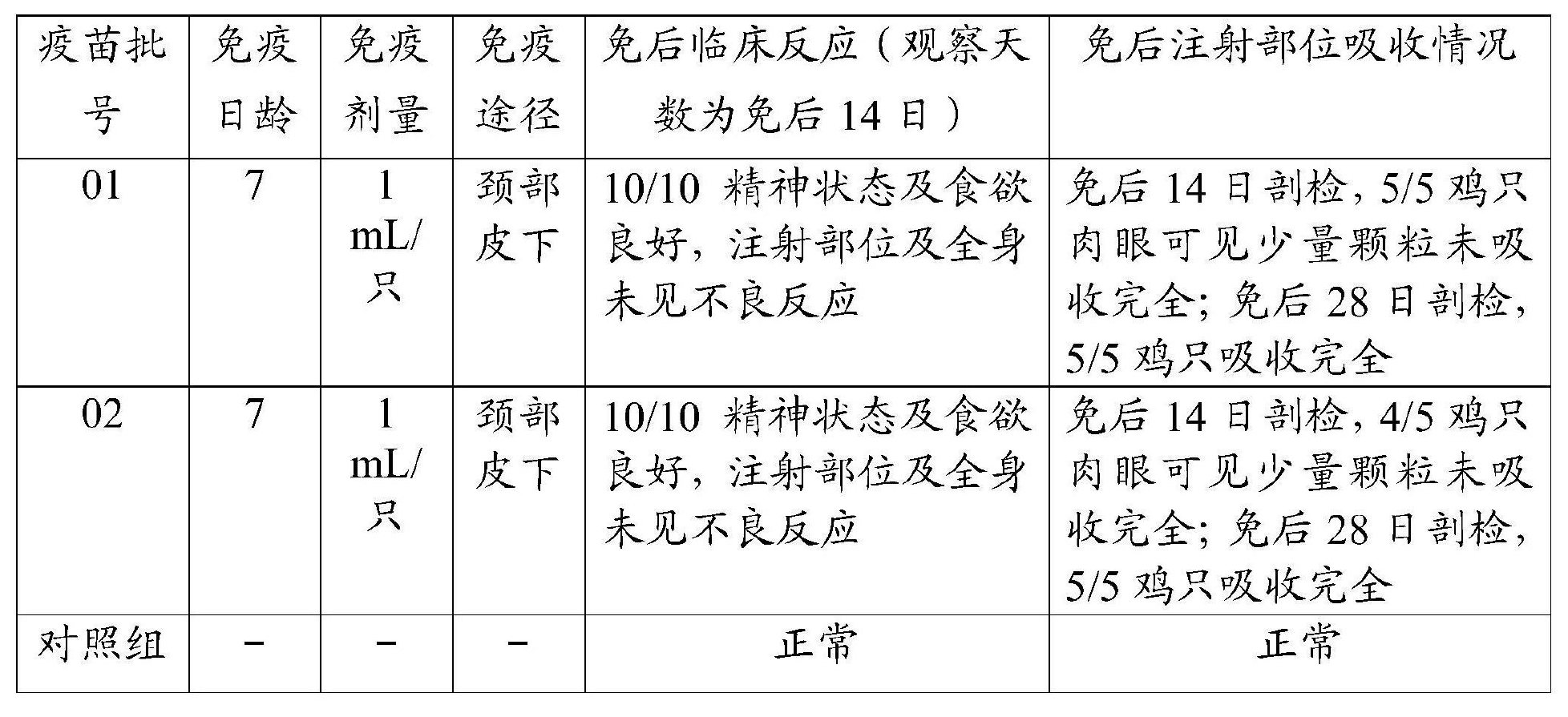
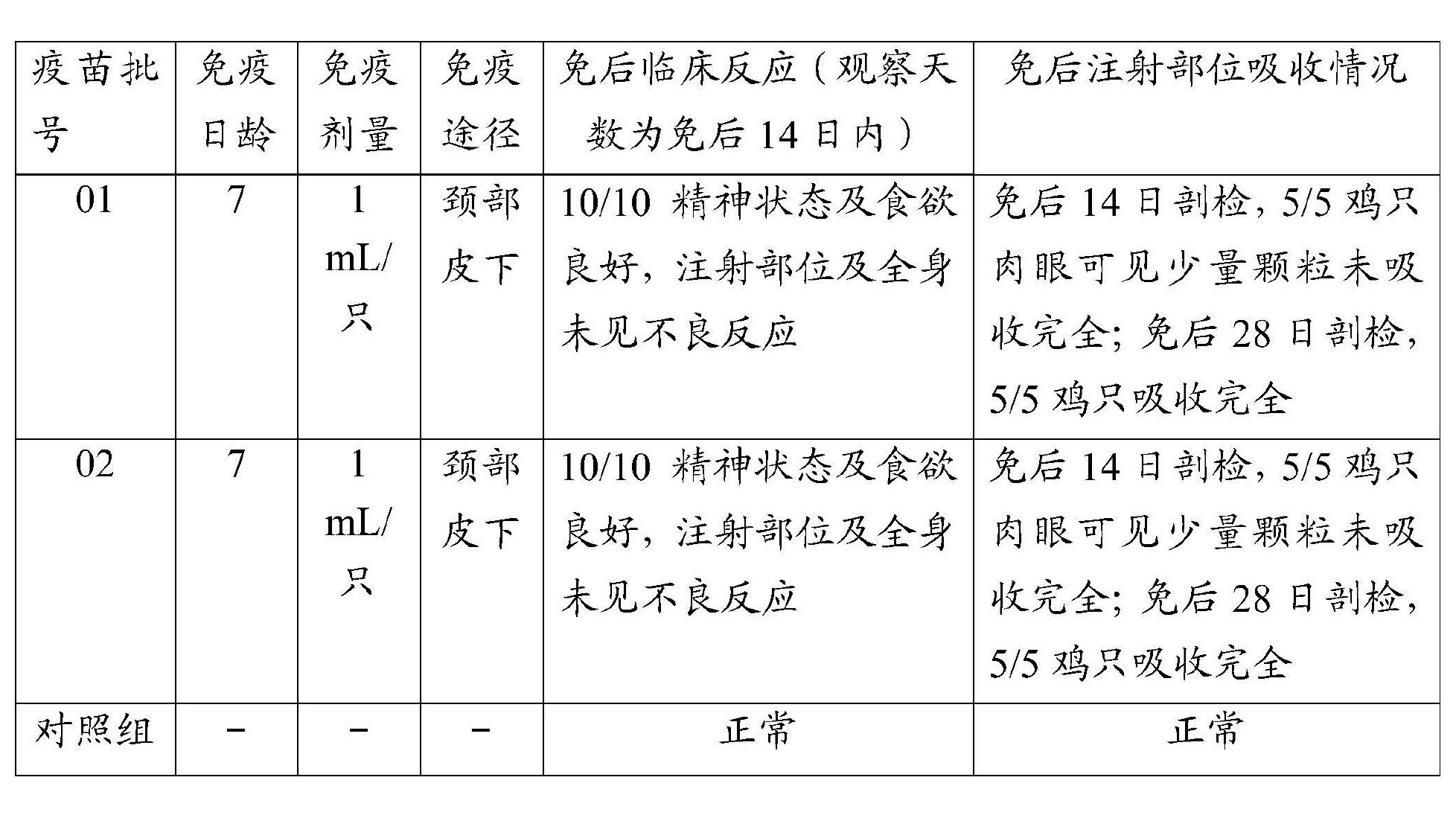
為了檢驗《一種禽流感H9亞型滅活疫苗及其製備方法和套用》製備的禽流感H9亞型滅活疫苗的安全性,按照上述方法製備2批次滅活疫苗,批號分別為01、02。分別接種7日齡SPF雞、7日齡黃雞,每組10隻,頸背部皮下注射該禽流感H9亞型滅活疫苗,1毫升/只(超劑量免疫),另設相同條件SPF、黃雞不接種作為對照,每組5隻。通過觀察接種後14日內是否出現由疫苗引起的任何局部和全身反應以及接種後14日、28日疫苗吸收情況,對疫苗安全性進行研究。其中,7日齡SPF雞購自新興大華農禽蛋有限公司SPF實驗動物中心,7日齡黃雞購自廣東溫氏食品集團股份有限公司欖根雞場。試驗結果見表8和表9。
表8 SPF雞免疫疫苗後安全性檢測結果
表9 黃雞免疫疫苗後安全性檢測結果
上述試驗結果顯示,7日齡SPF雞和7日齡黃雞接種《一種禽流感H9亞型滅活疫苗及其製備方法和套用》禽流感H9亞型滅活疫苗,14日內未觀察到臨床異常,採食、飲水正常,健康情況良好,未發現由疫苗引起的任何局部和全身不良反應。接種後14日剖檢注射部位,4/5以上接種雞肉眼可見少量顆粒未被吸收完全;注射後28日剖檢,5/5接種雞疫苗已吸收完全,注射部位均未見由疫苗接種引起的異常反應。因此,《一種禽流感H9亞型滅活疫苗及其製備方法和套用》的禽流感H9亞型滅活疫苗具有良好的安全性。
按照實施例2的方法製備禽流感H9亞型滅活疫苗,將製備的禽流感H9亞型滅活疫苗免疫21日齡SPF雞,0.3毫升/只,免後21日採血,分離血清,測定HI抗體效價,同時進行翅下靜脈攻擊AIVH9亞型不同地方分離毒株,攻毒劑量為0.2毫升/只,攻毒後第5日,採集每隻雞喉頭拭子,分別經尿囊腔接種9~10日齡SPF雞胚進行病毒分離。每隻雞的喉拭子樣品尿囊腔接種9~10日齡SPF雞胚5枚,孵育觀察96小時,無論死胚、活胚均應測定雞
胚液紅細胞凝集價,以5枚雞胚中有1枚雞胚液紅細胞凝集價不低於4log2(微量法)判為感染。對病毒感染為陰性的雞胚,盲傳一次。試驗具體分組詳見表10,結果見表11。
表10 SPF雞免疫攻毒試驗分組情況
表11 疫苗對SPF雞的免疫攻毒保護情況
上述試驗結果顯示,SPF雞免疫禽流感H9亞型滅活疫苗後第21日,產生了較高的禽流感H9亞型血清抗體,面對禽流感H9亞型不同地方毒株的攻擊,均產生了很好的免疫保護力,10隻雞均保護9隻以上。
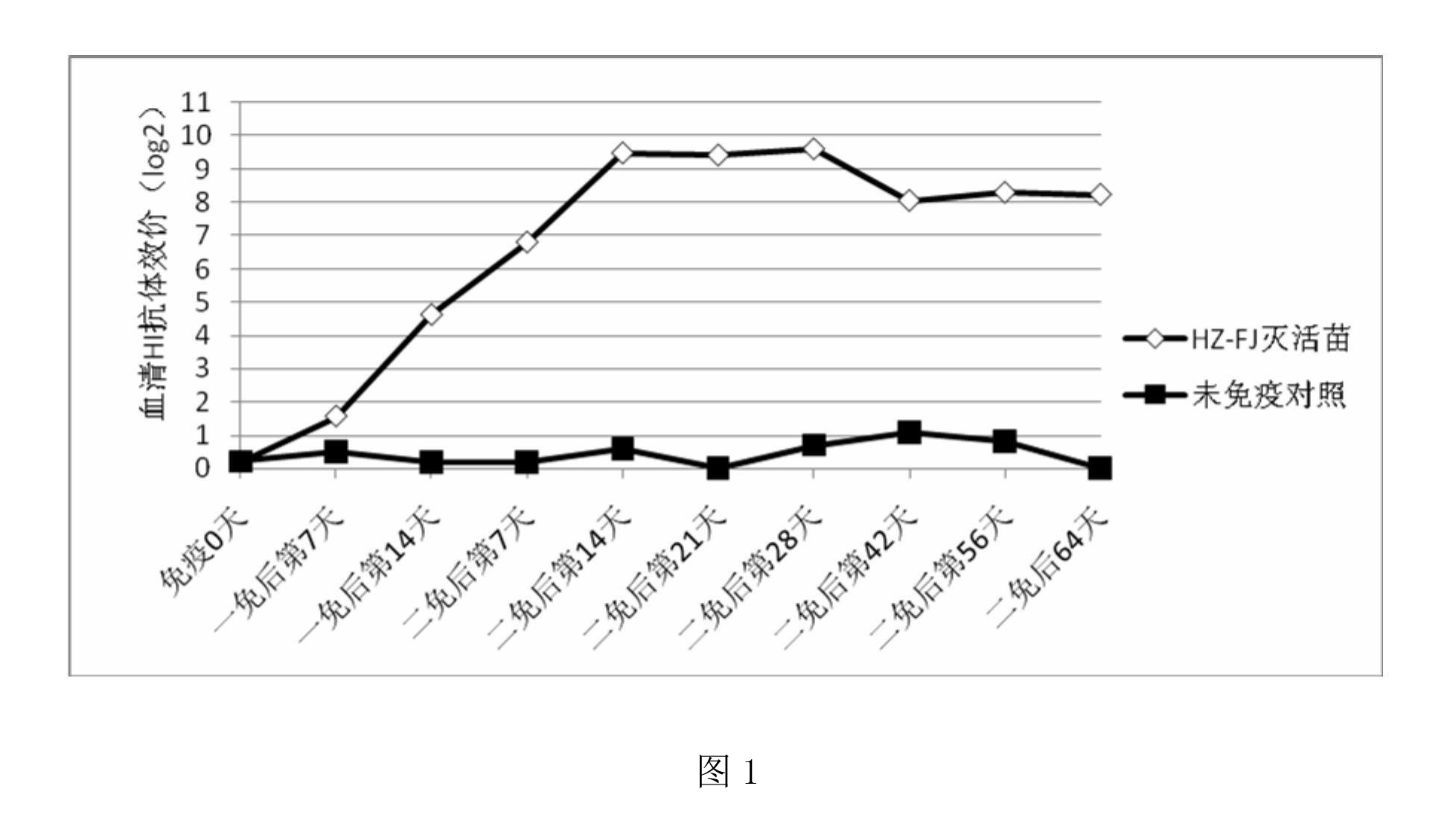
按照實施例2的方法製備禽流感H9亞型滅活疫苗,取21日齡黃雞32隻,平均分為2組,每組16隻。第1組接種禽流感H9亞型滅活疫苗0.3毫升/只,間隔2周后按同樣劑量再加強免疫一次;第2組不接種疫苗作為陰性對照。以後定期測定2組H9亞型禽流感抗體水平,分析免疫組抗體變化規律,試驗結果見圖1,圖中HZ-FJ滅活苗表示禽流感H9亞型滅活疫苗。
圖1的結果顯示,黃雞免疫禽流感H9亞型滅活疫苗後,於免後第7日開始產生免疫應答,在二免後14日抗體水平迅速上升,並於二免後14~28日內達到抗體高峰,直至二免後64日仍可維持在8log2以上。
實施例5:竹絲雞免疫禽流感H9亞型滅活疫苗後HI抗體消長規律測定
按照實施例2的方法製備禽流感H9亞型滅活疫苗,取14日齡竹絲雞32隻,平均分為2組,每組16隻。第1組接種禽流感H9亞型滅活疫苗0.3毫升/只,間隔2周后按同樣
劑量再加強免疫一次;第2組不接種疫苗作為陰性對照。以後每周測定2組H9亞型禽流感抗體水平,分析免疫組抗體變化規律,試驗結果見圖2,圖中HZ-FJ滅活苗表示禽流感H9亞型滅活疫苗。
圖2的結果顯示,竹絲雞在首免當天(14日齡)時,體內仍具有一定水平的禽流感H9亞型母源抗體,達4log2,隨著雞隻日齡的增長,其母源抗體迅速降低至趨於0,免疫組雞從一免後第7日開始,新產生的禽流感H9血清抗體基本呈直線上升,至二免後第7日,疫苗誘導的血清抗體達到峰值,高達11log2,然後逐漸趨於穩定,至二免後第49日,抗體水平仍可維持在8log2以上。
榮譽表彰 2018年12月20日,《一種禽流感H9亞型滅活疫苗及其製備方法和套用》獲得第二十屆中國專利優秀獎。