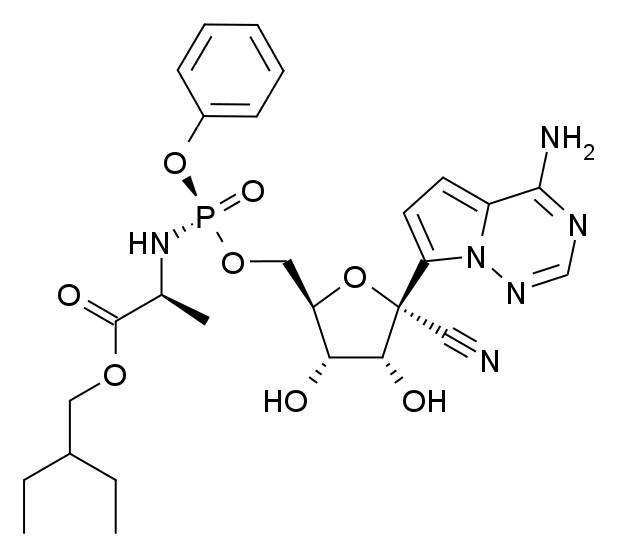
瑞德西韋(Remdesivir),是一種核苷類似物,具有抗病毒活性,在 HAE 細胞中,對 SARS-CoV 和 MERS-CoV 的 EC50 值為 74 nM,在延遲腦腫瘤細胞中,對鼠肝炎病毒的 EC50 值為 30 nM。
2020年5月7日,日本批准了美國吉利德科技公司研發的瑞德西韋作為國內首款新冠肺炎治療藥物,將被用於重症患者治療。2020年10月22日,美國食品藥品管理局(FDA)批准了吉利德科學的抗病毒藥物瑞德西韋用於治療新冠住院患者,成為美國首個正式獲批的新冠治療藥物。2020年11月20日,世界衛生組織20日發表聲明說:不論新冠住院患者病情多嚴重,都不建議使用抗病毒藥物瑞德西韋進行治療,因為尚無證據表明該藥能提高患者生存率或降低患者對呼吸機的需求等。
基本介紹
- 藥品名稱:瑞德西韋
- 外文名:Remdesivir
- 分子量:602.576
- 分子式:C27H35N6O8P
- CAS登錄號:1809249-37-3
- EINECS登錄號:210-629-4
- 密度:1.47 g/cm
- 折射率:1.652
藥物簡介,物化性質,製備,用途,發展情況,專利問題,產品定價,
藥物簡介
物化性質
密度:1.47 g/cm
折射率:1.652
油水分配係數:2.10
製備
Nature2016(Nature, 2016, Doi:10.1038/nature17180)介紹的第二代合成方法,實驗室可放大至百克級。共6步反應,收率分別為40%,85%,86%,90%,70%,69%,中間體6合成需要兩步,收率分別80%,39%。三磷酸核苷(NTP)的收率為28%。
用途
Remdesivir 是一種核苷類似物,具有抗病毒活性,在 HAE 細胞中,對 SARS-CoV 和 MERS-CoV 的 EC50 值為 74 nM,在延遲腦腫瘤細胞中,對鼠肝炎病毒的 EC50 值為 30 nM。
發展情況
2020年1月31日,權威醫學期刊《新英格蘭醫學雜誌》(NEJM)線上發表了多篇關於新型冠狀病毒(2019-nCoV)病例的論文,其中一篇介紹了美國首例確診病例的診療過程以及臨床表現,說明了一種名叫remdesivir(瑞德西韋)的藥物在抗新型冠狀病毒時展現出較好的療效,但其有效性還要經過大規模臨床試驗才能得到進一步驗證。Remdesivir(瑞德西韋)尚未在任何國家獲得批准上市,其安全性和有效性也未被證實。Remdesivir(瑞德西韋)是在研藥物,沒有針對2019-nCoV的數據。在沒有任何已獲批的治療方案的情況下,治療醫生權衡了風險和獲益後提出用藥請求,在當地監管機構的支持下,吉利德提供了試驗性藥物Remdesivir(瑞德西韋),用於少數2019-nCoV感染者的急症治療。
2020年2月2日,北京日報客戶端記者獲悉,跨國藥企吉利德研發的注射用新藥瑞德西韋臨床試驗申請已經獲得藥監部門受理。該臨床試驗即將由北京中日友好醫院在武漢疫區進行。
2020年2月6日,在科技部、國家衛健委、國家藥監局等多部門支持下,抗病毒藥物瑞德西韋(remdesivir)已完成臨床試驗的註冊審批工作,第一批病例入組工作也已就位。首批新型冠狀病毒感染的肺炎重症患者2月6日接受用藥。
2020年2月8日,吉利德公司針對瑞德西韋的治療及專利等問題發表了官方聲明,強調是無償供應藥物,並且在加大供應量,而且吉利德強調早就申請了治療冠狀病毒的專利,暫不考慮供應成本及財務回報等問題。
2020年2月8日,吉利德公司表示:“如果初步研究的結果表明瑞德西韋治療2019-nCoV感染的潛在安全性和有效性,我們會努力制定各種方案,通過適當的渠道將瑞德西韋這種試驗性藥物向更多患者開放。我們也正與多家機構就未來臨床試驗的可能性進行討論。”同時,吉利德還表示,正在利用這部分庫存滿足“同情用藥”的需求,以及計畫在中國進行的兩項臨床試驗的需求。雖然尚未確定該藥物是否可以安全有效地治療2019-nCoV感染,但考慮到當前情況的緊迫性,我們正在採取多種措施加快生產進度,增加供應,包括拓展了外部製藥合作夥伴網路,以加快原材料的採購,原料藥和藥品的生產;同時,開始在內部製造瑞德西韋,以作為外部生產網路產能的補充。“我們正在與中國政府和醫療機構積極展開合作,支持對2019-nCoV感染者開展臨床試驗。我們也與政府機構保持著定期溝通,更新我們在擴大生產規模的方面的最新進展。”
2020年2月15日,在國務院聯防聯控機制舉行的新聞發布會上,科技部生物中心主任張新民稱,瑞德西韋是一種國外公司研製的用於抗伊波拉病毒感染的藥物,在國外的臨床試驗還沒有全部做完,中國科學家開展的體外實驗顯示,具有對新冠病毒較好的抑制作用和安全性,該藥在美國也實現了對1位患者的成功治療。張新民稱,“我們在武漢推動在十餘家醫療機構開展該藥物臨床研究,已入組重症患者168例,輕型、普通型患者17例,期待早日得到臨床試驗的結果。”
2020年2月17日,美國吉利德科學首席醫療官Merdad Parsey博士在接受新華社獨家採訪時表示,“瑞德西韋”效果仍有待臨床檢驗,研究人員約在1個月左右得到部分數據,該藥物正24小時儘可能生產。
2020年2月21日,國務院應對新型冠狀病毒感染肺炎疫情聯防聯控機制舉行新聞發布會,介紹科技創新支撐疫情防控有關情況。對於瑞德西韋,科學技術部副部長徐南平表示,瑞德西韋正在武漢10家醫院進行比較大規模臨床試驗,已入組200多例重症和危重症患者,30多例輕型患者。不過,徐南平表示,此項臨床試驗是雙盲試驗,尚未揭盲,還不知曉試驗結果。但會一直保持和瑞德西韋研發企業吉利德公司保持良好溝通,如果臨床效果好,雙方會找到合適的藥物供給方法。
2020年2月25日,國務院聯防聯控機制在北京舉行新聞發布會,國家知識產權局副局長何志敏在新聞發布會上表示,瑞德西韋處於臨床階段,已在武漢多家醫院正式開始了該藥物的臨床試驗,4月27日公布臨床的試驗結果。
2020年2月25日,美國國家衛生研究院(NIH)宣布,已在美國內布拉斯加大學醫學中心啟動抗病毒藥物瑞德西韋治療新冠肺炎的首次臨床試驗,以隨機、安慰劑對照的方法展開。第一名參與試驗的患者是從日本“鑽石公主”號遊輪上撤僑回國的美國人。
2020年2月26日,美國吉利德公司表示,該公司開始對抗病毒藥物瑞德西韋進行兩項後期研究,以測試其在新冠病毒引起的重症和中度症狀患者身上的效果。吉利德將進行的這兩項後期研究中,第一項研究將在大約400名重症患者身上測試5到10天,而第二項研究將在大約600名中度症狀患者身上進行測試。該公司還表示,從3月開始,將在亞洲以及其他新冠病毒感染確診病例較多的國家進行相關後期研究,對近1000名患者測試瑞德西韋的效果。
2020年4月24日,據英國《金融時報》援引世界衛生組織發布的檔案草稿稱,吉利德科學針對新冠病毒的潛在藥物瑞德西韋在其首次隨機臨床試驗中失敗。瑞德西韋療效存疑。吉利德在一份聲明中稱,這份摘要對研究結果表述有誤,該研究因參與患者數量不足而提前終止。參與率較低的研究得出的結果,更難給出定論。
4月29日,美國國家過敏和傳染病研究所(NIAID)所長福奇表示,瑞德西韋在NIAID的一項隨機雙盲對照試驗中顯示出了療效,可以適度加快感染新冠病毒患者的康復速度。該試驗共招募了來自全球多個國家的1063名新冠肺炎患者。初步結果表明:瑞德西韋治療組的康復時間中位數為11天,而安慰劑對照組的康復時間中位數為15天,瑞德西韋治療組比安慰劑對照組康復快31%(p
2020年4月30日,世界頂級醫學期刊柳葉刀線上發表了王辰、曹彬團隊針對新冠肺炎重症患者的隨機、雙盲、安慰劑對照多中心試驗結果。該研究顯示,與安慰劑組相比,接受瑞德西韋治療並不能加快重症患者的恢復速度,也未能減少死亡。但患者可更快獲臨床改善。吉利德科學方面宣布的開放標籤的SIMPLE三期臨床試驗的頂線結果顯示,接受瑞德西韋5天療程的患者與接受10天瑞德西韋療程的患者的臨床改善相似。
2020年5月1日,美國食品藥品監督管理局(FDA)為尚在研究中的抗病毒藥物瑞德西韋(remdesivir)發放了治療新冠肺炎的緊急使用授權(EUA),用於治療疑似或確診新冠肺炎的重症患者,包括成年人和兒童。
據日本共同社報導,當地時間2020年5月7日,日本厚生勞動省在日本國內首次批准“瑞德西韋”作為治療新冠病毒感染者的藥物。
吉利德科學方面宣布的開放標籤的SIMPLE三期臨床試驗的頂線結果顯示,接受瑞德西韋5天療程的患者與接受10天瑞德西韋療程的患者的臨床改善相似。“這些數據令人鼓舞,因為它們表明接受瑞德西韋較短的5天治療療程的患者與接受10天治療療程的患者得到了相似的臨床改善”,史丹福大學醫學院免疫功能不全性宿主傳染病學首席臨床醫學教授、這項試驗的主要研究者之一、醫學博士Aruna Subramanian說,“儘管仍需要其他數據,如果證明瑞德西韋是安全且有效的,這些結果有助於使人們更清楚地了解如何最佳化其診療方案。”
2020年5月26日,據BBC報導,英國國民醫療服務體系(NHS)將開始對部分新冠肺炎病人使用抗病毒藥物瑞德西韋(Remdesivir)。
2020年6月1日,印度最高藥品監管機構批准了抗病毒藥物瑞德西韋(remdesivir)用於治療新冠肺炎成人和兒童“重症”住院病例。
2020年6月9日,在《自然》雜誌發表的一項研究表明,採用抗病毒藥物瑞德西韋進行早期治療,可減少在恆河猴體內的新冠病毒載量。這一發現支持在使用瑞德西韋治療新冠肺炎時,應儘可能早地開始,以使治療效果最大化。
美國時間2020年6月17日,吉利德科學全球首席醫療官Merdad Parsey博士代表吉利德科學發表聲明稱,吉利德科學已經設計並即將開始入組一項開放標籤、單臂2/3期臨床試驗,以評估瑞德西韋的安全性、耐受性、藥物代謝動力學和有效性。試驗將治療大約50名中度至重症新型冠狀病毒肺炎的兒科患者,涵蓋新生兒到青少年。這項重要的試驗將在美國和歐洲的超過30箇中心進行。
6月22日,吉利德科學董事長兼執行長Daniel O'Day在公司官網發布公開信,其中透露,該公司旗下治療瑞德西韋在新冠治療領域的多個動態,包括已取得美國FDA的批准,將開始對吸入型瑞德西韋進行試驗。Daniel O'Day在公開信中介紹,吸入製劑研究是探索在治療新冠肺炎(COVID-19)早期階段使用瑞德西韋的方法之一,吸入製劑將通過霧化器給藥,吉利德科學將在本周篩選健康的志願者進行1期臨床試驗,並希望在8月開始其針對新冠肺炎患者的研究。
6月25日,歐洲藥品管理局(EMA)官網發布訊息稱,歐盟藥監局人類藥物委員會(CHMP)建議,向瑞德西韋授予有條件的銷售許可,用於治療需要補充氧氣的成人和12歲以上的青少年新冠肺炎患者。
7月3日,歐盟委員會批准醫療機構使用瑞德西韋治療新冠肺炎。
7月10日,美國加州福斯特市,吉利德科學在第23屆國際愛滋病大會(AIDS 2020: Virtual)的新型冠狀病毒肺炎線上會議上,公布了瑞德西韋的更多數據。分析表明,與標準治療相比,接受瑞德西韋治療可以顯著加快臨床康復並降低62%的死亡風險。對比分析結果顯示,74.4%接受瑞德西韋治療的患者在14 天內康復,對於接受標準治療的患者,這一比例為59.0%。康復的定義為基於7分有序量表的臨床狀況的改善。在分析中,接受瑞德西韋治療的患者在第 14天的死亡率為 7.6%,而未接受瑞德西韋治療的患者的死亡率為12.5%。
7月10日,澳大利亞醫療用品管理局(TGA)臨時批准了吉利德的Veklury (瑞德西韋)上市,用於重症住院COVID-19成人和青少年患者。這是澳大利亞獲批的首個COVID-19治療藥物。
加拿大衛生部當地時間7月28日披露,已批准瑞德西韋(remdesivir)作為治療新冠肺炎重症患者的藥物,令其成為首款加官方批准用於新冠肺炎治療的藥物。
7月29日,歐盟官方網站發布訊息,稱7月28日歐盟委員會與吉利德科學(Gilead)簽署了一項契約,以確保瑞德西韋的治療劑量。歐盟稱,從8月初開始,為了滿足當前的需求,將在委員會的協調和支持下,向會員國和英國提供一批瑞德西韋。
8月29日,吉利德宣布,美國FDA已授予Veklury緊急使用授權(EUA),用於治療中度COVID-19患者。此次EUA擴大了Veklury之前的授權,允許將該藥用於治療所有COVID-19住院患者,無論氧氣狀況如何。
10月8日,吉利德科學公告稱國家過敏和傳染病研究所進行的有關瑞德西韋的ACTT-1試驗的最終結果發表在《新英格蘭醫學雜誌》(NEJM)上,擴大了Veklury(Remdesivir)治療COVID-19的臨床益處。ACTT-1是一項國際、隨機、安慰劑對照的3期試驗,評估了瑞德西韋在10天療程及標準治療中,對1000例輕度/中度至重度住院成人患者的作用,包括新冠肺炎的症狀、重症患者和篩查時需要機械通氣的症狀。該試驗是由美國國家過敏和傳染病研究所進行的,吉列德捐贈該藥物。結果關鍵數據為:第29天的最終數據顯示,在接受護理標準的住院患者中,瑞德西韋的療效優於安慰劑;總體而言,與安慰劑相比,瑞德西韋治療可加快五天恢復並減少疾病進展;瑞德西韋使基線低血氧病人在第29天的死亡率降低了70%。ACTT-1的最終研究結果基於在2020年5月發表於NEJM的初步結果,表明與COVID-19患者的安慰劑相比,瑞德西韋的治療在多個結局評估中產生了一致的、臨床上有意義的改善。最終結果表明,用瑞德西韋治療的恢復時間比以前報告的要快。
10月22日,美國食品藥品管理局(FDA)批准了吉利德科學的抗病毒藥物瑞德西韋用於治療新冠住院患者,成為美國首個正式獲批的新冠治療藥物。
2021年12月3日,吉利德科學發布了《關於瑞德西韋和SARS-CoV-2奧密克戎變異株的聲明》稱,對SARS-CoV-2奧密克戎變異株的現有遺傳學信息進行了分析,結果發現與之前變異毒株相比,病毒RNA聚合酶中並未發現新的普遍突變。這提示瑞德西韋仍對奧密克戎變異株具有活性。吉利德表示將開展實驗室測試以確認這一分析結果。《聲明》解釋說,瑞德西韋通過靶向病毒RNA聚合酶直接抑制SARS-CoV-2在受感染的細胞內複製。通過對奧密克戎變異分離株的200多個現有序列(包括來自南非、亞洲和歐洲的序列)的初步遺傳學分析表明,與之前的病毒變異株相比,奧密克戎變異株中不存在預期能夠改變SARS-CoV-2病毒RNA聚合酶的新突變。這提示瑞德西韋對奧密克戎變異株仍具有活性。
2022年4月,據《華爾街日報》報導,美國食品藥品監督管理局(FDA)周一表示,已擴大對瑞德西韋(Veklury)的批准,將其作為首個用於嬰幼兒的新冠療法。
2022年4月25日,美國食品和藥物管理局25日緊急授權新冠抗病毒藥物瑞德西韋治療範圍擴大至滿28天且體重達3.5千克的嬰兒。這一藥物此前只適用於12歲以上人群。
專利問題
對於武漢病毒所科研人員申請瑞德西韋用於抗新型冠狀病毒的專利一事,公司回應稱,吉利德研發了瑞德西韋,並在美國、中國及世界其他地區擁有專利。2016年,針對瑞德西韋在冠狀病毒上的套用,吉利德在中國以及全球申請了更多的專利。在中國,對於冠狀病毒套用的專利申請尚待批准。
此外吉利德稱,現階段討論任何強制許可或其他類型許可還為時過早。並未與監管部門就吉利德的生產供應成本或財務回報進行過任何的討論。
2020年2月25日,國家知識產權局副局長何志敏在國務院聯防聯控機制新聞發布會上說,吉利德公司在中國申請了有關瑞德西韋藥物的8項專利,其中3項已經授權,5項正在審查過程中,保護範圍涵蓋化合物、製劑和相關製造方法、用途等。
產品定價
2020年6月29日,吉利德科學董事長兼執行長Daniel O'Day在官網發表公開信稱,吉利德在已開發國家將瑞德西韋的政府定價設為每小瓶390美元。根據治療模式,預計絕大多數患者將接受5天療程使用6瓶瑞德西韋,相當於每位患者2340美元。
Daniel O'Day在公開信中表示,吉利德科學做這個決定背後的部分目的是,消除各國之間就價格進行談判的需要,將價格折讓至購買力最低的已開發國家可以承受的水平。該價格將提供給世界範圍內批准或授權使用瑞德西韋的已開發國家。
他強調,美國國家過敏和傳染病研究所(NIAID)研究在住院的新冠肺炎(COVID-19)患者中獲得的第一個結果表明,瑞德西韋將平均恢復時間縮短了四天,以美國為例,較早出院可為每位患者節省約12000美元的醫院費用。
在醫療資源、基礎設施和經濟狀況與已開發國家不同的開發中國家,吉利德表示,已經與仿製藥生產商達成協定,以大大降低的成本提供治療,這些替代解決方案旨在確保世界上所有國家都可以提供治療機會。早在5月13日,吉利德科學曾宣布,已經與5家位於印度和巴基斯坦的仿製藥生產商簽署了非獨占自願授權協定,以進一步擴大瑞德西韋的供應。該授權允許以下公司:Cipla Ltd., Ferozsons Laboratories, Hetero Labs Ltd.,Jubilant Lifesciences和Mylan公司生產瑞德西韋,並供應至127個國家。