甲烷(最簡單的有機物)
CH₄一般指本詞條
本詞條是多義詞,共1個義項
更多義項 ▼
收起列表 ▲
甲烷是具有正四面體結構的非極性分子,是最簡單的有機物。甲烷作為常規天然氣、頁岩氣、可燃冰等的主要組成成分,是非常重要的碳基資源。它是一種最主要的非CO2溫室氣體,在大氣的平流層,甲烷會被分解為水蒸氣(雲),從而導致臭氧層被破壞。
基本介紹
- 中文名:甲烷
- 外文名:methane
- 別名:碳烷
- 化學式:CH4
- 分子量:16.043
- CAS登錄號:74-82-8
- EINECS登錄號:200-812-7
- 熔點:-182.5 ℃
- 沸點:-161.5 ℃
- 水溶性:難(常溫常壓0.03)
- 密度:0.42(-164℃)(標準情況)0.717g/L
- 外觀:常溫下為無色無氣味氣體
- 閃點:-188 ℃
- 安全性描述:S9;S16;S33
- 危險性符號:R12
- UN危險貨物編號:1971
- 分類:鏈狀脂肪烴(GB/T 37885-2019)
- 發現:20世紀40年代首次發現空氣中存在甲烷
來源,物理性質,甲烷爆炸極限,化學性質,製備,實驗室制甲烷,煤轉化生成甲烷,甲烷的生成機制,套用,直接轉化制高值化學品,間接轉化,開採,
來源
在今天的大氣中,有大約20%的甲烷來自古代,是在幾百萬年前就存在於煤層、海底、天然氣礦藏和融化了的永久凍土下面而到今天才釋放出來的。而近代產生的甲烷,來源主要有牛、泥沼、瀝青、稻田、新開墾的土地、腐敗的垃圾和白蟻等。無論哪種來源,都是由細菌在缺氧條件下進行的有機物分解,若是有氧則會產生CO2。
物理性質
無色、可燃、無毒氣體,沸點是-161.49℃。甲烷對空氣的重量比是0.54,溶解度差。
甲烷爆炸極限
在正常氣壓下,甲烷的爆炸下限(LEL)為5-6%,爆炸上限(UEL)為15-16%;甲烷在空氣中的濃度達到9.5%時,就會發生最強烈的爆炸。其中,氧濃度降低時爆炸下限變化不大,而爆炸上限明顯降低;當氧濃度低於12%時,混合氣體就失去爆炸性。
化學性質
(1)既不與高錳酸鉀等強氧化劑反應,也不與強酸、強鹼反應。
(2)甲烷可與氯氣發生取代反應
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+Cl2 CCl4+HCl
(3)可火焰燃燒和催化燃燒
CH4+2O2 CO2+2H2O
催化劑一般貴金屬催化劑中使用Pd基催化劑、Pt基催化劑、Au基催化劑或Pd-Pt、Pd-Rh、Pd-Au和Pd-Pt-Rh等多組分貴金屬催化劑。
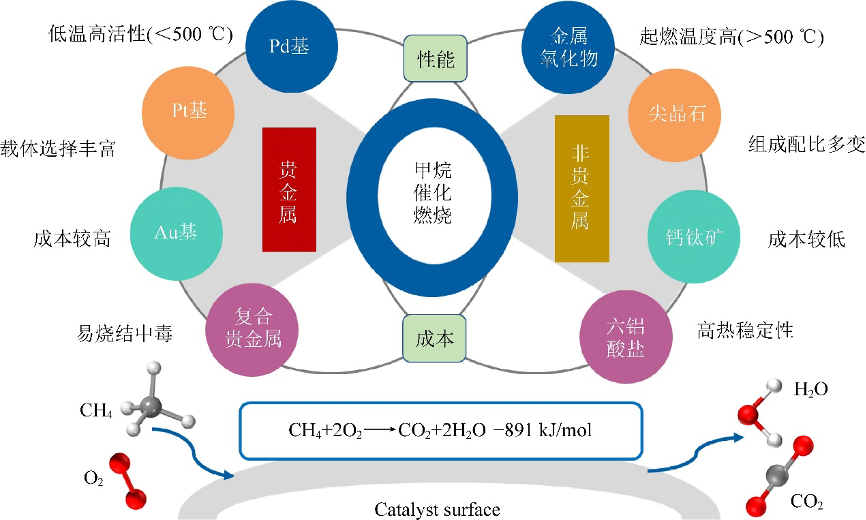 用於甲烷催化燃燒的貴金屬和非貴金屬催化劑
用於甲烷催化燃燒的貴金屬和非貴金屬催化劑 製備
實驗室制甲烷
CH3COONa CH3·+·COONa
CH3·+NaOH CH4+·ONa
·ONa+CH3COONa CH3·+Na2CO3
CH3·+CH3COONa CH3COCH3+·ONa
CH3·+CH3· C2H6
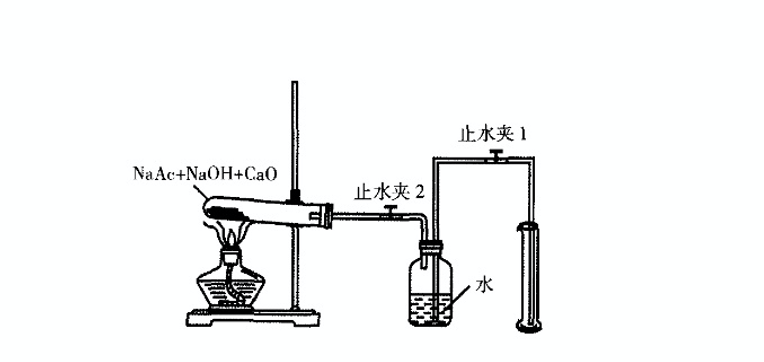 實驗裝置
實驗裝置 煤轉化生成甲烷
Coal CO+H2
CO+H2O CO+H2
CO+H2 CH4+CO2+H2O
煤炭熱解生成甲烷
(1)機理
煤樣直接一次熱解與活潑H生成甲烷:Coal-CH3+H Coal+CH4
熱解生成固態產物的氫化反應:C(固)+2H2 CH4
前期熱解生成液態產物的二次熱解也是生產甲烷的途徑之一。
甲烷的生成機制
原煤:分為四個階段。
第一階段屬於吸附甲烷的脫除。
第二階段有兩種反應共同作用生成,分別是甲氧基中甲基的脫落,生成二氧化碳和甲烷或醇類官能團中甲基的脫落,生成甲烷和水。
第三階段甲苯熱解生成甲烷和苯,其次是亞甲基橋鍵斷裂和氫化芳香環的脫甲基反應。
第四階段是芳香體系脫H與殘餘的C反應的結果。
套用
直接轉化制高值化學品
(1)甲烷氧化偶聯制乙烯(OCM)
1982年,KELLER等首次報導了甲烷氧化偶聯制C
2烴的反應過程。1985年,DRISCOLL等首先提出OCM遵循異相和均相反應相結合的反應機理。甲烷的C—H鍵首先被催化均裂生成氣相甲基自由基,然後偶聯為
乙烷,乙烷進一步在催化劑上或氣相中脫氫轉化為
乙烯。LUO等採用同步輻射真空紫外光電離質譜(SVUV-PIMS)技術首次線上檢測到Li-MgO催化甲烷和乙烷氧化反應中的氣相甲基自由基、乙基自由基、過氧甲基自由基、甲基過氧化氫和乙基過氧化氫等重要氣相中間體,為OCM和乙烷氧化脫氫反應的機制研究提供了直接的實驗證據。
(2)甲烷無氧芳構化制芳烴(MDA)
1993年,WANG等報導了Mo/ZSM-5催化甲烷無氧芳構化制苯等芳烴的反應,提出了雙功能機理,即活性Mo物種和Brønsted酸位分別作為甲烷活化和C2烴芳構化的活性位,得到了廣泛認可。但是,部分研究者認為活性Mo物種擁有固有芳構化特性,分子篩骨架為活性Mo位提供錨定位點,十元環的擇形環境促進了芳烴的形成。2018年,KOSINOV等的研究取得了突破性進展,並提出了“烴池機理”,即甲烷活化後的初級產物與分子篩限域的芳香型積炭發生二次反應,形成苯等芳烴。VOLLMER等提出了類似的Mars-van-Krevelen機理(MvK),活性Mo位上含碳原子,該碳原子在反應中參與苯環的形成。ÇAĞLAYAN等和KOSINOV等認為MDA過程中存在兩條獨立的C—H鍵活化路徑。
(3)甲烷無氧直接制乙烯
GUO等採用HAADF-STEM、in situ XAS等技術表征研究表明,MTOAH反應中Fe©SiO2的活性位為單原子鐵配位兩個碳原子和一個矽原子形成的單鐵中心(FeSiC2); XIE等報導單原子Pt1@CeO2催化MTOAH過程 ,經DRIFTS研究結果顯示,反應後Pt1@CeO2存在具有π鍵的乙烯和乙炔等吸附物種,這說明單Pt位可能具有穩定C2烴吸附物種的能力。EGGART等採用火焰噴霧熱解法(FSP)製備了Pt-CeO2單原子催化劑,operando XAS結果表明,在反應條件下Pt與Ce成鍵,歸因於CeO2對Pt的包覆修飾或者Pt—Ce合金的形成。HAO等採用氫原子裡德堡標識飛行時間譜-交叉分子環化裝置,首次在實驗中檢測到MTOAH過程產生的氫自由基,其形成速率隨反應溫度的增加而增加,還發現由1,2,3,4-四氫萘(THN)和苯等供氫分子熱裂解產生的氫自由基可以提升甲烷轉化率及烯烴和芳烴的收率,並降低乙烯形成的起活溫度,由此提出了氣相氫自由基促甲烷活化反應機制(·H + CH4→ H2 + ·CH3)。
間接轉化
通過重整生產合成氣(一氧化碳和氫氣混合氣),合成氣經甲醇路徑、費托合成或新的OXZEO過程獲得高值化學品。
(1)甲烷水蒸氣重整(SRM)
CH4+H2O = CO+3H2……Δ Δ =206kJ·mol
(2)甲烷催化部分氧化(POM)
2CH4+O2 = 2CO+4H2……Δ Δ =-44·kJ·mol
(3)甲烷二氧化碳重整(CDM)
CH4+CO2 = 2CO+2H2……Δ Δ =+247 ·kJ·mol
(4)甲烷的CO2-O2聯合重整
CO2-O2聯合重整 CH反應是將甲烷催化部分氧化這一放熱過程和甲烷二氧化碳重整這一吸熱過程相結合來製備合成氣。
開採
| | | |
| | 以遼寧撫順模式、山西陽泉模式和重慶天府模式為代表,分別形成了高透氣高瓦斯特厚煤層瓦斯抽采技術、穿層鑽孔鄰近層卸壓瓦斯抽采技術和高瓦斯突出煤層群保護層開採技術等 | 以礦井瓦斯災害防治為目的,抽采瓦斯絕大部分直接排放至大氣中 |
| | 保護層卸壓瓦斯抽采、低透煤層水力強化瓦斯抽采等技術不斷推廣,初步構建形成中國瓦斯綜合抽采技術體系 | 瓦斯抽采技術不斷發展,井下瓦斯抽采利用項目得到推進,高濃度抽采瓦斯開始用於工業和民用 |
| | 以安徽淮南模式為代表,形成複雜煤層群留巷鑽孔法卸壓瓦斯抽采技術體系 | 瓦斯抽采技術和模式進一步發展,瓦斯抽采逐漸形成規模化,抽采量和利用量均快速增加 |
| | 以重慶松藻模式、山西晉城模式為代表,分別形成了“三區配套三超前增透抽采”與“三區聯動煤層氣(瓦斯)井上下立體遞進抽采”模式等 | 瓦斯抽采技術和模式逐漸成熟,低濃度和超低濃度煤礦瓦斯的利用取得進展,瓦斯利用範圍不斷拓展 |
| | 逐步構建形成“采前-采中-采後”煤炭開發全生命周期瓦斯抽采減排技術體系 | 強調對溫室氣體排放的管控,瓦斯抽采技術進一步向智慧型化、精準化方向發展;鼓勵低濃度瓦斯和乏濃度瓦斯的綜合高效利用,最終形成全濃度瓦斯階梯式綜合利用模式 |
(表格數據來源)



