專利背景 口蹄疫 (Foot-and-mouth disease,FMD)是由FMD病毒(Foot-and-mouth disease virus,FMDV)引起的豬、牛和羊等偶蹄動物感染的一種急性、熱性、高度接觸性傳染病。FMDV是一種單股正鏈RNA病毒,屬小RNA病毒科(Picornaviridae),口蹄疫病毒屬(Aphtho virus)。該病毒分為7個血清型(A、O、C、Asial、SAT1、SAT2、和SAT3型),其中A型口蹄疫病毒流行較為廣泛,是僅次於O型口蹄疫的世界主要流行毒株。截至2013年5月,口蹄疫疫情頻繁發生且呈全球化流行的態勢,這不僅對世界畜產品經濟構成了巨大的威脅,而且引發了人們對食品安全等社會公共衛生問題的擔憂,造成發生疫情的國家及地區的畜產品貿易損失慘重。
A型口蹄疫多在中國周邊國家發生和流行,中國於1958年在新疆阿克陶地區首次發現
A型口蹄疫 。1963年初從
蒙古國 傳入中國內蒙古地區並引發較大規模的流行,疫情波及中國7省200多個縣市,而在此後的近40年間,無A型口蹄疫疫情流行,然而2009年年國中國武漢、上海地區相繼爆發了A型口蹄疫疫情,並很快傳播到多個省份,這些病原屬於ASIA拓撲型毒株。2013年2月,廣東茂名暴發豬A型口蹄疫。2013年4月25日,西藏拉薩市達孜縣塔傑鄉塔傑村也發生牛A型口蹄疫疫情。2013年5月2日,新疆阿克蘇地區阿瓦提縣拜什艾日克鎮索克曼村發生牛A型口蹄疫疫情。經國家口蹄疫參考實驗室和世界口蹄疫參考實驗室分析,2013年發生口蹄疫疫情的病原都屬於東南亞97毒株(SEA-97毒株),是境外新傳入疫情,與2009年的毒株同屬ASIA拓撲型,同源性在92%左右,而與中國歷史毒株同源性較低。A型口蹄疫的暴發使得中國原本複雜的防疫形勢更加嚴峻。
口蹄疫抗原變異毒株產生的原因是抗原表位胺基酸序列變異產生抗原多樣性的結果,抗原表位是誘變宿主免疫應答的重要物質基礎,疫苗株與流行毒株的抗原表位匹配的好壞決定著疫苗免疫保護率的高低。A型口蹄疫流行病毒的複製能力及病毒穩定性較低,全基因組序列分析表明,其3′UTR核苷酸和細胞受體結合部位的VP1的胺基酸有變異,在此位置有胺基酸發生變異可能意味著毒株複製能力和毒株抗原性的改變。進化樹分析表明,暴發的A型口蹄疫來自東南亞國家,與國內曾經出現過的A型流行毒無遺傳衍化關係。疫苗接種是防控口蹄疫的主要手段之一,從流行毒中篩選新的疫苗種毒是最常見、快速的的一種方法,但不是每個流行毒都能馴化成為理想的疫苗種毒,往往是免疫原性(抗原譜匹配,免疫動物後誘導動物機體產生足夠的免疫力)或生產性能(收毒時間、產毒量和病毒穩定性)不符合要求。
理想的疫苗種毒來之不易,創新疫苗種毒篩選技術,建立疫苗種毒更新的長效機制十分急迫。口蹄疫反向遺傳操作技術的成熟為我們提供了解決疫苗種毒篩選的新方法,利用其可對病毒基因進行改造和修飾,人工篩選獲得預期生物學特性的毒株,通過替換P1基因與流行毒抗原迅速匹配,獲得優良疫苗毒株並製備成疫苗用來防控流行毒株。
發明內容 專利目的 《A型口蹄疫重組疫苗株及其製備方法和套用》的目的在於解決當前缺乏抗原匹配、生產性能不好的A型口蹄疫疫苗株的技術問題,提供一種A型口蹄疫重組疫苗株及其製備方法和套用,用該疫苗株滅活製備疫苗,免疫牛28天后,用10000倍BID50 毒劑量進行攻毒實驗,連續觀察12天,結果表明:全劑量100%保護。50%保護劑量(PD50 )在10.81~13.59,該疫苗可用於中國及其周邊國家A型口蹄疫病毒的預防和控制;同時也提供一種A型口蹄疫重組無致病性疫苗株及其製備方法和套用,該疫苗株對豬和牛均無致病性,能夠誘導宿主早期免疫應答,不形成血毒症且不排毒,提高了疫苗株的生物安全性。
技術方案 一種A型口蹄疫重組疫苗株,其特徵在於:所述A型口蹄疫重組疫苗株具有高滴度、與流行病毒的抗原匹配性高,免疫保護率高的特徵,該疫苗株的抗原核苷酸序列為SEQ ID NO:1所示。
一種A型口蹄疫重組無致病性疫苗株,其特徵在於:在上述A型口蹄疫重組疫苗株的基礎上將L基因進行突變,所述A型口蹄疫重組無致病性疫苗株具有高滴度、與流行病毒的抗原匹配性高,免疫保護率高、並且對豬和牛無致病性、不形成血毒症、不排毒,且能誘導宿主產生早期免疫應答等特徵,該疫苗株的L基因序列為SEQ ID NO:2所示。
一種所述A型口蹄疫重組疫苗株的製備方法,其特徵在於:(1)A型口蹄疫重組疫苗株真核轉錄質粒的構建,該真核轉錄質粒在病毒全長cDNA兩側嵌有榔頭錘酶(hammerhead ribozyme,HamRz)和戊型肝炎酶(hepatitis delta ribozyme,HdvRz),在其外側的5′端添加有聚合酶I和聚合酶II轉錄啟動子,在3′端有終止子;以O型口蹄疫病毒拯救系統為骨架,通過AflII和SgrAI限制性內切酶,用A/WH/CHA/09毒株含有部分L和P1基因的序列SEQ ID NO:1替換相應基因,得到prA-FMDV的重組質粒;所用A/WH/CHA/09毒株是2009年1月分離於湖北武漢,經BHK-21傳代培養10代,保藏於農業部獸醫局指定保存單位:國家口蹄疫參考實驗室,使用RNAeasyMiniKit提取A/WH/CHA/09毒株的總RNA,用引物oligNotI反轉錄合成病毒第一鏈cDNA,以合成的第一鏈cDNA為模板,用引物AP1-F和AP1-R擴增獲得A/WH/CHA/09毒株部分L和P1的基因片段,上述三條針對A/WH/CHA/09株的特異性引物分別是:
oligNotI:5`-ttttctagagcggccgct38 -3′
AP1-F:5′-ttttccttaagggacaggaacatgctgtgtttgcctgcgt-3′
AP1-R:5′-tattttcaccggtgcaataattttctgcttgtgtctgtc-3′,
在以上的特異性引物中,擴增A/WH/CHA/09毒株部分L和P1基因序列所用上游引物AP1-F中含AflII限制性酶切位點;下游引物AP1-R中含下劃線部分的SgrAI限制性酶切位點,用上述特異性引物進行擴增,得到A/WH/CHA/09毒株部分L和P1基因片段,大小為2400bp,構建50微升反應體系,擴增條件為:94℃5分鐘,94℃30秒,57℃30秒,68℃2分鐘30秒,goto2,35個循環,72℃8分鐘,PCR擴增產物經0.8%瓊脂糖凝膠電泳核實後進行純化回收並送交測序,獲得上述基因片段的DNA;
prO/CHA/99是該實驗室前期構建的含有O/CHA/99毒株全長cDNA的質粒,其中,O/CHA/99毒株是O型口蹄疫毒株,1999年分離於中國香港,現保存於
國家口蹄疫參考實驗室 ,prO/CHA/99質粒組成是在病毒基因組5′端上游含人巨細胞病毒RNA聚合酶II啟動子及編碼牛生長素多聚苷酸化信號的修飾剪下序列,在其兩者間含鼠源RNA聚合酶I啟動子;在病毒基因組3′端下游含鼠源聚合酶終止子I和聚合酶終止子II序列;及嵌合在O型口蹄疫病毒O/CHA/99全長cDNA基因組兩端的榔頭錘酶和戊型肝炎酶的核心序列,其中戊型肝炎酶共有88個核糖核酸,自我剪下修飾位點在5′末端G處;榔頭錘酶核心序列共有58個核糖核酸,自我剪下修飾位點在3′末端C處,將含O型口蹄疫病毒O/CHA/99基因組的感染性克隆轉染至受體細胞中,通過RNA聚合酶II啟動子和RNA聚合酶I啟動子調控元件分別轉錄包裝出病毒RNA前體,再經HamRz和HdvRz的修飾剪下產生具有感染性的病毒RNA,將O型口蹄疫病毒O/CHA/99株拯救系統的質粒prO/CHA/99與上述得到的A/WH/CHA/09毒株部分L和P1片段,分別用AflII和SgrAI雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株部分前導蛋白L和結構蛋白P1的重組質粒,將重組質粒命名為prA-FMDV,且僅位點1與流行毒株有差異;
(2)A型口蹄疫重組質粒prA-FMDV轉染口蹄疫病毒敏感細胞,具體為BHK-21細胞或IBRS-2細胞,拯救獲得所述的與流行毒株抗原匹配的A型口蹄疫重組病毒;該真核轉錄質粒在適應細胞、乳鼠和豬體內均能夠拯救出相應病毒。
所述的A型口蹄疫重組疫苗株的製備方法,其特徵在於:用所述重組質粒prA-FMDV直接轉染口蹄疫病毒敏感細胞BHK-21細胞或IBRS-2細胞,得到與流行毒株抗原匹配的A型口蹄疫重組病毒。
一種所述A型口蹄疫重組無致病性疫苗株的製備方法,其特徵在於:(1)A型口蹄疫重組無致病性疫苗株真核轉錄質粒的構建,在上述重組質粒prA-FMDV的基礎上,將L基因SAP區域(SAF-A/B,Acinus,andPIAS)突變,其構建過程是:將表達質粒pCDNA3.1(+)用特異性引物進行擴增,得到含有PacI和AflII酶切位點的基因片段,上述引物分別是:
pCD-AflII-ApaI-F:5′-ttttccttaaggggcccgtttaaacccgctgat-3′
pCD-PacI-NheI-R:5′-cttacttaattaagctagccagcttgggtctcccta-3′
同時將重組質粒prA-FMDV,經PacI和AflII雙酶切後,與上述得到的含有PacI和AflII酶切位點的pCDNA基因片段連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含5’UTR和部分L基因的重組質粒,將重組質粒命名為pCD-OL;以鑑定正確的重組質粒pCD-OL為模板,用磷酸化突變引物F-P和SAP-P進行PCR擴增,上述5′磷酸化的點突變引物分別是:
F-P:5′-gacctcacagggcttgaactgcacga-3′
SAP-P:5′-ctccgcctgcttggcggctgcaagcgtg-3′,
在以上的磷酸化的點突變引物中,將L基因中SAP區域進行突變,用此對引物進行平末端擴增,純化回收PCR產物,經室溫連線5分鐘後,轉化大腸桿菌JM109,測序鑑定點突變後的陽性克隆,將得到的定點突變重組質粒命名為pCD-OL-SAP;
將已獲得的重組質粒prA-FMDV與上述得到的L基因中SAP區域進行突變後的重組質粒pCD-OL-SAP,分別用PacI和AflII雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株的P1基因和L基因中SAP區域突變的重組質粒,將重組質粒命名為prA-SAP-FMDV;
(2)A型口蹄疫重組無致病性疫苗株真核轉錄質粒prA-SAP-FMDV轉染口蹄疫病毒敏感細胞,BHK-21細胞或IBRS-2細胞,拯救獲得所述的與流行毒株抗原匹配且無致病性的A型口蹄疫重組病毒。
所述的A型口蹄疫重組無致病性疫苗株的製備方法,其特徵在於:在重組質粒prA-FMDV的基礎上,對L基因的SAP進行突變,將重組質粒prA-SAP-FMDV直接轉染口蹄疫病毒敏感的細胞BHK-21細胞或IBRS-2細胞,得到重組病毒rA-SAP-FMDV對豬和牛都沒有致病性,並且不形成血毒症,不排毒,能夠產生較強和較早的免疫應答。
一種所述A型口蹄疫重組疫苗株製成的疫苗,其特徵在於:培養的A型口蹄疫重組疫苗株用二乙烯亞胺(Binaryethyleni分鐘e,BEI)滅活,濃縮純化後與ISA206佐劑以1∶1體積比混合製備疫苗,免疫豬和牛後有效刺激機體產生免疫應答,並提供豬和牛體免疫保護作用,對A型AISA譜系毒株的10000倍牛半數感染劑量(BID50 )攻毒實驗,免疫保護率能達100%,半數保護劑量(PD50 )為10.81~13.59。
一種所述A型口蹄疫重組疫苗株和A型口蹄疫重組無致病性疫苗株在製備預防A型口蹄疫病毒導致的疾病的疫苗中的套用,該疫苗可用於中國及其周邊國家A型口蹄疫病毒的預防和控制。
改善效果 中國口蹄疫A型武漢毒的流行,對滅活苗種毒的篩選與更換提出了新的研究課題。該病毒細胞病變時間不穩定、滴度低,達不到生產要求。2013年5月前國際通行的疫苗種毒篩選原則是:一是抗原譜對號,可對當前流行毒株有效保護;二是免疫原性強,可誘導動物產生足夠強的免疫應答反應;三是生產性能好,疫苗候選毒株具有病變時間短、滴度高和病變穩定等較好的生產性能,可用於工業化生產。從流行毒種篩選新的疫苗株是最常見和最能快速見效的一種方法,直接解決了抗原譜對號的問題。但對另外兩個問題,免疫原性和生產性能問題,仍然需要試驗來證明。而現實情況是,並不是每一個流行毒株都能馴化成理想的疫苗種毒,往往是免疫原性或生產性能不符合要求。通過大量的試驗表明,理想的疫苗種毒得之不易,創新疫苗種毒篩選(構建)技術,建立疫苗種毒更新的長效機制十分急迫。
口蹄疫反向遺傳技術的成熟為我們提供了解決疫苗種毒的篩選的新方法。通過反向遺傳技術實現對病毒基因的改造和修飾,能夠人工獲得預期生物學特性的毒株,並可以與流行毒株配型,以期與變異迅速的流行毒株進行匹配。可以儘量減少流行毒株馴化環節帶來負面影響。為以後快速製備高效疫苗奠定堅實的基礎,對整體提高FMD疫苗質量具有重要意義。《A型口蹄疫重組疫苗株及其製備方法和套用》就是藉助已經建立的高效反向遺傳系統,通過相關基因的改造,來建立病變時間短、病毒滴度高的毒株,解決篩選疫苗種毒的生產和馴化問題,以此疫苗毒株框架為構建高效疫苗種毒奠定基礎。
依據口蹄疫分子流行病學,利用反向遺傳學進行FMD疫苗株多種表型改善和提高。
1)在病毒整體水平上提高了FMD疫苗株的生產性能(如病毒滴度和病變時間),《A型口蹄疫重組疫苗株及其製備方法和套用》製備的毒株能夠提高滴度100倍以上,降低了抗原製備成本。將流行毒株A/WH/CHA/09部分L和P1基因進行替換並拯救出重組病毒rA-FMDV,測定病毒生物學特徵,結果表明,該重組病毒rA-FMDV具有病變時間短、滴度高的特點,重組病毒rA-FMDV在第5代,病變時間降為11小時,從第5代至第9代完全病變時間穩定在10小時左右。而流行毒A/WH/CHA/09在第6代至12代,完全病變時間在25~20小時左右,在13代後,病變時間才縮短在10小時左右。rA-FMDV的病毒滴度(TCID50 )在第5代達6.8,從第5代至第9代病毒滴度穩定在7.5以上,而流行毒在第5代滴度為2.8,從第5代至第9代病毒滴度穩在2.8至4.5之間。由此可見重組病毒顯著提高了其生產性能。
2)實現提高疫苗毒株抗原匹配性和免疫應答性,《A型口蹄疫重組疫苗株及其製備方法和套用》構建的疫苗毒株的結構蛋白與流行毒株一致,抗原完全匹配,提高了疫苗株與流行毒株的針對性;
3)《A型口蹄疫重組疫苗株及其製備方法和套用》製備的疫苗株含有潛在的疫苗標識位點,為後期開發標記疫苗奠定基礎;
4)與流行毒株製備的疫苗相比,《A型口蹄疫重組疫苗株及其製備方法和套用》製備的疫苗株提高了疫苗免疫應答和保護性高,PD50 值在10.81~13.59,增強了疫苗田間防控效果;
5)《A型口蹄疫重組疫苗株及其製備方法和套用》的重組無致病性疫苗株rA-SAP-FMDV對豬和牛都沒有致病性,而且不形成血毒症,不排毒,能夠產生早期的免疫應答。
6)並且根據周邊國家疫情,藉助《A型口蹄疫重組疫苗株及其製備方法和套用》技術,可以建立有針對性的疫苗戰略儲備庫,實現無需流行毒株(不動活毒)的疫苗毒株構建方式;
7)《A型口蹄疫重組疫苗株及其製備方法和套用》技術改變了疫苗毒株篩選馴化技術受病毒自然屬性制約大、費時費力、成功率低的缺陷,可以實現更為主動有效的疫苗毒株構建,實現了口蹄疫滅活疫苗毒種製備工藝的革新,具有重大套用價值,提升疫苗毒種技術工藝,屬於國際領先水平。
附圖說明 圖1為實例1中口蹄疫病毒A/WH/CHA/09株部分L和P1基因片段的電泳圖。
圖2為實例2中口蹄疫病毒拯救系統prO/CHA/99。
圖3為實例2中A型口蹄疫病毒重組質粒prA-FMDV的構建策略。
圖4為實例2重組毒株與流行毒株位點1差異比較圖。
圖5為實例3中拯救重組病毒rA-FMDV、rA-SAP-FMDV感染BHK-21細胞後引起的CPE。
圖6為實例4.1中接種了拯救重組病毒rA-FMDV的BHK-21細胞間接免疫螢光圖。
圖7為實例5.2中拯救重組病毒rA-FMDV與流行毒株A/WH/CHA/09在BHK-21細胞上的致病力試驗比較圖。
技術領域 《A型口蹄疫重組疫苗株及其製備方法和套用》屬於生物技術和生物製品領域,具體涉及一種利用反向遺傳操作技術製備的A型口蹄疫重組疫苗株及其製備方法和套用,利用該方法製備兩種疫苗株,一種是效價高、抗原匹配性和免疫保護率高的A型口蹄疫重組疫苗株,另一種是效價高、抗原匹配性、免疫保護率高且對宿主無致病性的A型口蹄疫重組無致病性疫苗株,同時可以利用上述兩種疫苗株生產兩種疫苗。
權利要求 1.一種A型口蹄疫重組疫苗株的製備方法,其特徵在於:該疫苗株是通過如下方法製備得到的:步驟1)A型口蹄疫重組疫苗株真核轉錄質粒的構建:獲得A/WH/CHA/09毒株部分L和P1的基因片段,其序列如SEQ ID NO:1所示;將O型口蹄疫病毒O/CHA/99株拯救系統的質粒prO/CHA/99與上述得到的A/WH/CHA/09毒株部分L和P1的基因片段,分別用AflII和SgrAI雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株部分前導蛋白L和結構蛋白P1的重組質粒,將重組質粒命名為prA-FMDV;步驟2)A型口蹄疫重組無致病性疫苗株真核轉錄質粒的構建:在步驟1)所述的重組質粒prA-FMDV的基礎上,將L基因SAP區域突變,其構建過程是:將表達質粒pCDNA3.1(+)用特異性引物進行擴增,得到含有PacI和AflII酶切位點的基因片段,上述引物分別是:pCD-AflII-ApaI-F:5'-ttttccttaaggggcccgtttaaacccgctgat-3'pCD-PacI-NheI-R:5'-cttacttaattaagctagccagcttgggtctcccta-3'同時將重組質粒prA-FMDV,經PacI和AflII雙酶切後,與上述得到的含有PacI和AflII酶切位點的pCDNA基因片段連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含5’UTR和部分L基因的重組質粒,將重組質粒命名為pCD-OL;以鑑定正確的重組質粒pCD-OL為模板,用磷酸化突變引物F-P和SAP-P進行PCR擴增,上述5'磷酸化的點突變引物分別是:F-P:5'-gacctcacagggcttgaactgcacga-3'SAP-P:5'-ctccgcctgcttggcggctgcaagcgtg-3',在以上的磷酸化的點突變引物中,將L基因中SAP區域進行突變,用此對引物進行平末端擴增,純化回收PCR產物,經室溫連線5分鐘後,轉化大腸桿菌JM109,測序鑑定點突變後的陽性克隆,將得到的定點突變重組質粒命名為pCD-OL-SAP;將已獲得的重組質粒prA-FMDV與上述得到的L基因中SAP區域進行突變後的重組質粒pCD-OL-SAP,分別用PacI和AflII雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株的P1基因和L基因中SAP區域突變的重組質粒,將重組質粒命名為prA-SAP-FMDV;步驟3)A型口蹄疫重組無致病性疫苗株真核轉錄質粒prA-SAP-FMDV轉染口蹄疫病毒敏感細胞,具體為BHK-21細胞或IBRS-2細胞,拯救獲得所述的與流行毒株抗原匹配且無致病性的A型口蹄疫重組病毒。
2.根據權利要求1所述的A型口蹄疫重組疫苗株的製備方法,其特徵在於:在重組質粒prA-FMDV的基礎上,對L基因的SAP進行突變,將重組質粒prA-SAP-FMDV直接轉染口蹄疫病毒敏感的細胞BHK-21細胞或IBRS-2細胞,得到重組病毒rA-SAP-FMDV對豬和牛都沒有致病性,並且不形成血毒症,不排毒,能夠產生較強和較早的免疫應答。
3.一種利用權利要求1或2所述的A型口蹄疫重組疫苗株的製備方法製備的A型口蹄疫重組疫苗株,其特徵在於:所述A型口蹄疫重組無致病性疫苗株具有高滴度、與流行病毒的抗原匹配性高、免疫保護率高、並且對豬和牛無致病性、不形成血毒症、不排毒、且能誘導宿主產生早期免疫應答等特徵,該疫苗株的抗原核苷酸序列為SEQ ID NO:1,L基因核苷酸序列為SEQ ID NO:2所示。
實施方式 操作內容 《A型口蹄疫重組疫苗株及其製備方法和套用》結合國家口蹄疫參考實驗室近年來的毒株積累和對其全基因組序列的分析研究,將中國A型口蹄疫毒株A/WH/CHA/09的部分前導蛋白L和結構蛋白P1基因,通過限制性內切酶位點與由建立的O型口蹄疫病毒O/CHA/99株的拯救系統中相應核苷酸序列進行替換,得到一種A型口蹄疫病毒重組質粒prA-FMDV;所述特異性核苷酸序列如SEQ ID NO:1所示。
一種製備A型口蹄疫重組疫苗株的反向遺傳作業系統,該系統包含:(1)真核轉錄質粒,該轉錄質粒能夠表達所述重組A型口蹄疫病毒全長基因cDNA序列,質粒在病毒全長cDNA兩側嵌有核酶(hammerhead ribozyme(HamRz)和hepatitis delta ribozyme(HdvRz)),在其外側的5′端添加有聚合酶(polymerase,pol)I和polII轉錄啟動子,在3′端有終止子;(2)A型口蹄疫重組質粒prA-FMDV轉染敏感細胞,優選BHK-21細胞或IBRS-2細胞。所述A型口蹄疫重組病毒是用上述拯救系統拯救獲得的,該質粒可以在適應細胞、乳鼠和豬體內拯救出相應病毒。
A型口蹄疫重組病毒的感染性克隆,是以O型口蹄疫病毒疫苗株的拯救系統為骨架,通過AflII和SgrAI限制性內切酶,用A/WH/CHA/09毒株含有部分L和P1基因替換相應基因,得到prA-FMDV的重組質粒。
一種A型口蹄疫重組病毒的製備方法,使用所述重組質粒,直接轉染口蹄疫病毒敏感的細胞,優選BHK-21細胞或IBRS-2細胞,得到與流行毒株抗原匹配的A型口蹄疫重組病毒,該方法製備的A型口蹄疫重組病毒,命名為rA-FMDV。
上述A型口蹄疫病毒重組質粒prA-FMDV的構建方法,是採用特異性引物對A型口蹄疫毒株A/WH/CHA/09的基因組進行擴增,得到部分前導蛋白L和結構蛋白P1基因。利用特異的AflII和SgrAI酶切位點對O型口蹄疫病毒的質粒prO/CHA/99進行基因替換,構建得到A型口蹄疫病毒重組質粒命名為prA-FMDV。轉染BHK-21細胞第2代48小時出現致細胞病變(CPE),連續傳代後經RT-PCR、間接免疫螢光、反向間接血凝和乳鼠致病力實驗等均檢測到了拯救的FMDV。經生物學特性測定後,與流行毒相比重組病毒rA-FMDV具有病變時間短,病毒滴度高的特點。
上述A型口蹄疫重組病毒疫苗株的套用中,將由A型口蹄疫重組病毒感染性克隆得到的基因工程病毒rA-FMDV,滅活製成疫苗,測定該疫苗的PD50 在10.81~13.59之間。解決實際生產中的難題,獲得了改良的A型口蹄疫高效疫苗毒株。通過攻毒後的帶毒狀況檢測,發病牛能夠檢測到帶毒,而免疫保護牛沒有形成帶毒現象。綜合上述指標,該重組毒株是一個高效疫苗株。
一種A型口蹄疫重組無致病性的重組質粒製備方法,利用特異性的磷酸化引物對A型口蹄疫病毒重組質粒prA-FMDV的L基因的SAP區域進行點突變,利用PacI和AflII酶切位點替換已構建的重組質粒prA-FMDV的相應基因,構建得到SAP區域突變的A型口蹄疫病毒重組質粒,命名為prA-SAP-FMDV。轉染BHK-21細胞第5代48小時出現致細胞病變(CPE),連續傳代後經RT-PCR、間接免疫螢光、反向間接血凝和乳鼠致病力實驗等均檢測到了拯救的FMDV。經生物學特性測定後,與流行毒相比重組病毒rA-SAP-FMDV具有對宿主豬和牛均無致病性的特點。
實施案例 下面結合具體實施實例對《A型口蹄疫重組疫苗株及其製備方法和套用》做進一步地描述,但具體實施並不對《A型口蹄疫重組疫苗株及其製備方法和套用》做任何限定。
下列實施例中所使用的實驗方法如無特殊說明,均為常規條件,如《精編分子生物學實驗指南》(F.M.奧斯伯,R.E.金斯頓,J.G.賽德曼等主編,馬學軍,舒躍龍譯,北京:科學出版社,2004)中所述的方法進行。
實施例1 .A型口蹄疫病毒A/WH/CHA/09毒株部分L和P1基因序列的獲得。
《A型口蹄疫重組疫苗株及其製備方法和套用》人所用A/WH/CHA/09毒株由農業部獸醫局指定國家口蹄疫參考實驗室保藏,公眾可通過農業部獸醫局批示的委託函獲得。使用RNAeasyMiniKit(Qiagen公司)提取A/WH/CHA/09毒株的總RNA,用引物oligNotI反轉錄合成病毒第一鏈cDNA,以合成的第一鏈cDNA為模板,用引物AP1-F和AP1-R擴增獲得A/WH/CHA/09毒株的基因序列。上述三條針對A/WH/CHA/09株的特異性引物分別是oligNotI(5`-ttttctagagcggccgct38 -3′)AP1-F(5′-ttttccttaagggacaggaacatgctgtgtttgcctgcgt-3′)和AP1-R(5′-tattttcaccggtgcaataattttctgcttgtgtctgtc-3′)。在以上的特異性引物中,擴增A/WH/CHA/09毒株部分L和P1基因序列所用上游引物AP1-F中含AflII限制性酶切位點;下游引物AP1-R中含SgrAI限制性酶切位點(下劃線部分)。用上述特異性引物進行擴增,得到A/WH/CHA/09毒株部分L和P1基因片段,大小為2400bp(圖1),與預期大小相符。擴增所用適合長片段擴增、性能優良的PremixLA(TaKaRa公司)DNA聚合酶,按照產品說明書構建50微升反應體系,擴增條件為:94℃5分鐘,94℃30秒,57℃30秒,68℃2分鐘30秒,goto2,35個循環,72℃8分鐘,PCR擴增產物經0.8%瓊脂糖凝膠電泳核實後進行純化回收並送交測序,獲得上述基因片段的DNA;擴增產物的電泳結果如圖1所示。
實施例2 .A型口蹄疫重組病毒感染性克隆的構建。
在已建立的O型口蹄疫病毒O/CHA/99株拯救系統prO/CHA/99的框架基礎上,O型口蹄疫毒株拯救系統prO/CHA/99如圖2所示:在病毒基因組5`端上游含人巨細胞病毒RNA聚合酶II啟動子(Human cytomegalovirus RNA polymerase II promoter,PII )及編碼牛生長素多聚苷酸化信號的修飾剪下序列,在其兩者間含鼠源RNA聚合酶I啟動子(Mouse RNA polymerase I promoter,PI );在病毒基因組3`端下游含鼠源聚合酶終止子I(Murineter分鐘atorI,TI )和聚合酶終止子II(Murineter分鐘atorII,TII )序列;及嵌合在O型口蹄疫病毒O/CHA/99全長cDNA基因組兩端的榔頭錘酶(Hammerhead ribozyme,HamRz)和戊型肝炎酶(Hepatitis delta ribozyme,HdvRz)的核心序列,其中戊型肝炎酶共有88個核糖核酸,自我剪下修飾位點在5`末端G處;榔頭錘酶核心序列共有58個核糖核酸,自我剪下修飾位點在3`末端C處。將含O型口蹄疫病毒O/CHA/99基因組的感染性克隆轉染至受體細胞中,通過RNA聚合酶II啟動子和RNA聚合酶I啟動子調控元件分別轉錄包裝出病毒RNA前體,再經HamRz和HdvRz的修飾剪下產生具有感染性的病毒RNA。
將O型口蹄疫病毒O/CHA/99株拯救系統的質粒prO/CHA/99與實例1得到的部分L和P1片段分別用AflII和SgrAI雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株部分前導蛋白L和結構蛋白P1的重組質粒,將重組質粒命名為prA-FMDV(圖3),且僅位點1與流行毒株有差異(圖4)。
A型口蹄疫重組無致病性重組質粒製備方法:
A型口蹄疫重組病毒L基因SAP區域(SAF-A/B,Acinus,and PIAS)突變,其感染性克隆構建過程是:將表達質粒pCDNA3.1(+)用特異性引物進行擴增,得到含有PacI和AflII酶切位點的基因片段,上述引物分別是:
pCD-AflII-ApaI-F:5′-ttttccttaaggggcccgtttaaacccgctgat-3′
pCD-PacI-NheI-R:5′-cttacttaattaagctagccagcttgggtctcccta-3′
同時將重組質粒prA-FMDV,經PacI和AflII雙酶切後,與上述得到的含有PacI和AflII酶切位點的pCDNA基因片段連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含5’UTR和部分L基因的重組質粒,將重組質粒命名為pCD-OL;以鑑定正確的重組質粒pCD-OL為模板,用磷酸化突變引物F-P和SAP-P進行PCR擴增,上述5′磷酸化的點突變引物分別是:
F-P:5′-gacctcacagggcttgaactgcacga-3′
SAP-P:5′-ctccgcctgcttggcggctgcaagcgtg-3′,
在以上的磷酸化的點突變引物中,將L基因中SAP區域進行突變,用此對引物進行平末端擴增,純化回收PCR產物,經室溫連線5分鐘後,轉化大腸桿菌JM109,測序鑑定點突變後的陽性克隆,將得到的定點突變重組質粒命名為pCD-OL-SAP;
將已獲得的重組質粒prA-FMDV與上述得到的L基因中SAP區域進行突變後的重組質粒pCD-OL-SAP,分別用PacI和AflII雙酶切後,連線轉化至JM109感受態細胞中,測序鑑定陽性克隆,獲得含A/WH/CHA/09毒株的P1基因和L基因中SAP區域突變的重組質粒,將重組質粒命名為prA-SAP-FMDV;
實施例3 .A型口蹄疫重組病毒拯救。
用QIAGEN公司生產的PlusMaxiKit純化製備由實例2得到的含A型口蹄疫重組病毒全基因組cDNA的重組質粒prA-FMDV和prA-SAP-FMDV。待BHK-21單層生長至80%~90%時用於轉染。用OPTI-MEMI培養基清洗細胞,在脂質體Lipofecta分鐘e2000(Invitrogen公司)的介導下將4μg的重組質粒轉染BHK-21細胞,將其在含有5%CO2的37℃培養箱中培養,同時設立脂質體對照和正常細胞對照。轉染後4~6小時吸去細胞上清,加入MEM培養基(Invitrogen公司),繼續培養,觀察細胞病變的出現情況;待細胞出現90%左右病變時收穫病毒。反覆凍融3次後再次接種BHK-21細胞,直到病毒能穩定地產生CPE,出現細胞變圓,成葡萄狀分布,最終細胞崩解成碎片(如圖5所示)。將A型口蹄疫重組病毒命名為rA-FMDV;將A型口蹄疫病毒L基因SAP區域突變的重組病毒命名為rA-SAP-FMDV。在圖4中,A:為拯救重組病毒rA-FMDV感染BHK-21細胞出現的CPE的圖片;B:為正常對照BHK-21細胞圖片。C:為拯救重組病毒rA-SAP-FMDV感染BHK-21細胞出現的CPE的圖片
實施例4 .拯救A型口蹄疫重組病毒的鑑定。
4.1間接免疫螢光檢測病毒抗原。
將轉染後盲傳至第2代的BHK-21細胞,-70℃反覆凍融三次後,按一定比例接種至底部放置了載玻片的生長有BHK-21細胞的六孔板里(單層細胞生長至60%~70%),置於含5%CO2的37℃培養箱中,24小時後按常規方法做間接免疫螢光,一抗為A型FMDV兔陽性血清,二抗為標記FITC羊抗兔IgG(Sigma公司),同時設正常細胞對照。接種第2代細胞液的BHK-21細胞中可見綠色特異性螢光,而正常細胞對照無可見螢光產生(如圖6所示,A:為接種了拯救重組病毒rA-FMDV的BHK-21細胞;B:為未接種病毒的正常BHK-21細胞),表明重組病毒感染的BHK-21細胞中有FMDV蛋白的表達。
4.2反向間接血凝鑑定試驗
收集1ml在BHK-21細胞上傳代出現CPE的時間趨於穩定的第7代拯救病毒,58℃40分鐘滅活,將滅活後的病毒按1∶2做連續稀釋(同時設空白對照和流行毒A/WH/CHA/09的陽性對照),每個稀釋度取50微升加入96孔板中,再加入25微升FMDV抗體致敏化的綿羊紅細胞,置微量混合器上振盪1~2分鐘,加蓋,室溫放置2小時後觀察結果。當貼附於血細胞上的FMDV抗體與游離的抗原相遇時,形成抗原抗體凝集網路,綿羊紅細胞也隨之凝集,出現肉眼可見的血細胞凝集現象,從而根據細胞沉積情況判定結果。
結果顯示,按1∶32稀釋的rA-FMDV感染BHK-21細胞時發生紅細胞凝集,而未出現紅細胞沉積;1∶32稀釋的流行毒75%出現紅細胞凝集,陰性對照樣品出現紅細胞完全沉積;反向間接血凝試驗結果表明:引起BHK-21細胞病變的是FMDV。
實施例5 .拯救A型口蹄疫重組病毒的致病力試驗。
5.1對乳鼠致病力試驗。
將在BHK-21細胞分別傳至第9代的拯救病毒和流行毒分別用PBS緩衝液10倍倍比稀釋,各取10~10倍比稀釋的病毒液經皮下接種2~4日齡乳鼠,每個稀釋度各接種4隻,接種劑量為200微升/只,連續觀察8d。空白對照組4隻乳鼠接種PBS緩衝液200微升/只,觀察並記錄乳鼠的死亡情況,用Karber法計算LD50 。接種拯救病毒和流行毒的乳鼠在接種20小時後,部分表現出呼吸困難、後肢麻痹和用鑷子夾尾聲音嘶啞等症狀。48小時後接種流行毒和拯救重組病毒的乳鼠陸續死亡,對照組乳鼠正常。最後根據統計結果,計算出拯救病毒rA-FMDV的LD50 為10/0.2毫升,rA-SAP-FMDV的LD50 為10/0.2毫升,流行毒株A/WH/CHA/09的LD50 10/0.2毫升。
5.2在BHK-21細胞上的致病力試驗。
按照常規方法對BHK-21細胞進行消化,加入含10%胎牛血清的MEM細胞培養基,分裝於28個2毫升細胞培養瓶中,於37℃含有5%CO2的培養箱中培養,待細胞單層長到90%時備用。用MEM以10倍倍比稀釋病毒液,將各稀釋度(10~10)的病毒液分別加入2毫升細胞培養瓶,每個稀釋度4瓶,按10%接毒後37℃感作1小時,用不含血清的MEM清洗細胞2~3次,加入不含血清的MEM,放入37℃含有5%CO2的培養箱中進行培養,觀察3天,用Read-Muench氏法測定對BHK-21細胞的半數感染量(TCID50 )。按照該法測定拯救病毒rA-FMDV和親本毒1-9代的滴度,並統計各代病變時間。
拯救病毒rA-FMDV接種BHK-21細胞後,細胞傳代至第5代,病變時間降為11小時,從第5代至第9代完全病變時間穩定在10小時左右;而親本毒在第6代至12代,完全病變時間在25-20小時左右,在13代後,病變時間才縮短在10小時左右。用該毒進行TCID50 試驗,用Read-Muench氏法進行計算,改造的基因工程毒在第5代,滴度達6.8,從第5代至第9代病毒滴度穩定在7.5以上。親本毒在第5代滴度為2.8,從第5代至第9代病毒滴度穩在2.8至4.5之間。拯救病毒rA-SAP-FMDV傳代穩定後測定病毒滴度在7.17以上。
5.3重組病毒rA-SAP-FMDV的致病力試驗。
將BHK-21用含10%胎牛血清的MEM培養傳代。按常規轉瓶單層BHK-21傳代細胞培養法製備拯救重組病毒rA-SAP-FMDV,收穫的病毒液即為病毒培養物,置於-40℃保存,重組毒採用注射途徑進行攻毒,攻毒劑量為10TCID50 ,豬肌肉注射2毫升頭,牛舌部皮下注射2毫升頭,同時設立流行毒株A/WH/CHA/09對照組,連續觀察10天,測量體溫變化並觀察記錄發病情況。上述實驗用豬和牛均購自非疫區,並經國家口蹄疫參考實驗室生產的FMD液相阻斷ELISA(LPB-ELISA)檢測A型抗體均<1∶4。FMD非結構蛋白3ABC-ELISA抗體檢測為陰性。攻毒結果顯示,rA-SAP-FMDV攻毒後豬和牛均未出現臨床症狀,即對豬和牛均沒有致病性,見表1。
表1重組毒株和流行毒株A/WH/CHA/09致病力試驗臨床症狀
-表示無臨床症狀
5.4重組病毒rA-SAP-FMDV對豬和牛產生早期的免疫應答。
按照上述方法製備rA-SAP-FMDV重組病毒,分別對豬進行肌肉注射2毫升頭(5×10TCID50 ),對牛進行舌部皮下注射2毫升頭(5×10TCID50 ),並於接種後每天採集分離血清,用FMD液相阻斷ELISA(LPB-ELISA)檢測A型抗體,在第3天時抗體水平均大於1∶45,結果見表2。
表2rAsia1-RSD-SAP-FMDV重組病毒對豬牛攻毒後抗體水平變化表
實施例6.拯救A型口蹄疫重組病毒疫苗的製備及安檢。
將BHK-21用含10%胎牛血清的DMEM培養傳代。按常規轉瓶單層BHK-21傳代細胞培養法製備rA-FMDV拯救病毒液,收穫的病毒液即為病毒培養物,置於-40℃保存。將病毒培養物滅活用3mmol/l二乙烯亞胺(Binaryethyleni分鐘e,BEI)(Sigma公司)26℃滅活,24小時後再加入一次BEI,再滅活24小時。滅活後安檢,用抗原濃縮純化,將抗原收穫物與ISA206佐劑(法國SEPPIC)以1∶1比例混合製備疫苗。具體按照《中華人民共和國藥典》中獸用生物製品的口蹄疫滅活疫苗規程製備。安檢牛舌部皮下注射滅活病毒2毫升頭,連續逐日觀察6日,觀察期牛健康良好,蹄部和嘴鼻均無異常。
上述實驗用牛為購自非疫區,並經國家口蹄疫參考實驗室生產的FMD液相阻斷ELISA(LPB-ELISA)檢測O型和AsiaI型抗體均<1∶4。FMD非結構蛋白3ABC-ELISA抗體檢測為陰性。
實施例7 .疫苗免疫動物效果比對。
7.1疫苗免疫攻毒保護試驗
將上述實施例6中所得到的安檢合格的A型口蹄疫重組病毒疫苗免疫16頭牛,同時設2頭非免疫牛對照(要求被免疫的牛的口蹄疫抗敵滴度不小於1∶6,感染抗體為陰性),測定其免疫效力。攻毒方法及結果判定方法均按照《Manual of diagnostic tests and vaccines for terrestrial animals》(2009年版,世界動物衛生組織(OIE))中所述。免疫牛28天后,用10000倍ID50 毒劑量進行攻毒實驗,連續觀察12天,結果表明:用該A型口蹄疫重組病毒作為疫苗株,在培養的BHK-21細胞上增殖後滅活,與ISA206佐劑(法國SEPPIC)乳化製成疫苗,免疫牛,能有效保護中國當前A型口蹄疫流行毒的攻擊。結果如表3。
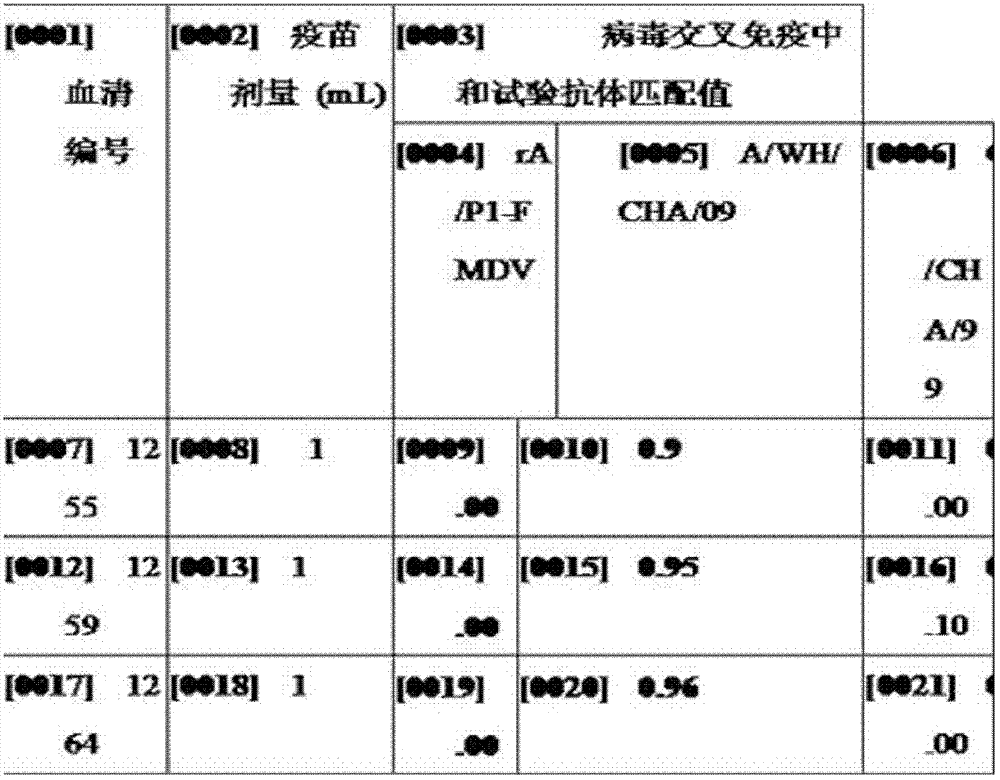
表3:A型口蹄疫重組病毒疫苗免疫牛攻毒後臨床症狀和保護情況 7.2交叉免疫中和實驗。
將上述實施例6中所得到的安檢合格的A型口蹄疫重組病毒疫苗免疫動物所得到的血清與rA-FMDV,A/WH/CHA/09和O/CHA/99三株毒進行病毒交叉免疫中和實驗,測定抗體匹配值r,其中1≥r≥0.3表明毒株與疫苗有高度匹配性,疫苗免疫動物後能抵抗此毒株的攻擊,可作為潛在疫苗株;r≤0.3表明毒株與疫苗匹配性較差,疫苗免疫動物後不能抵抗相應毒株的攻擊。結果如表4。
表4.病毒交叉免疫中和試驗rA-FMDV,A/WH/CHA/09和O/CHA/99的抗體匹配值
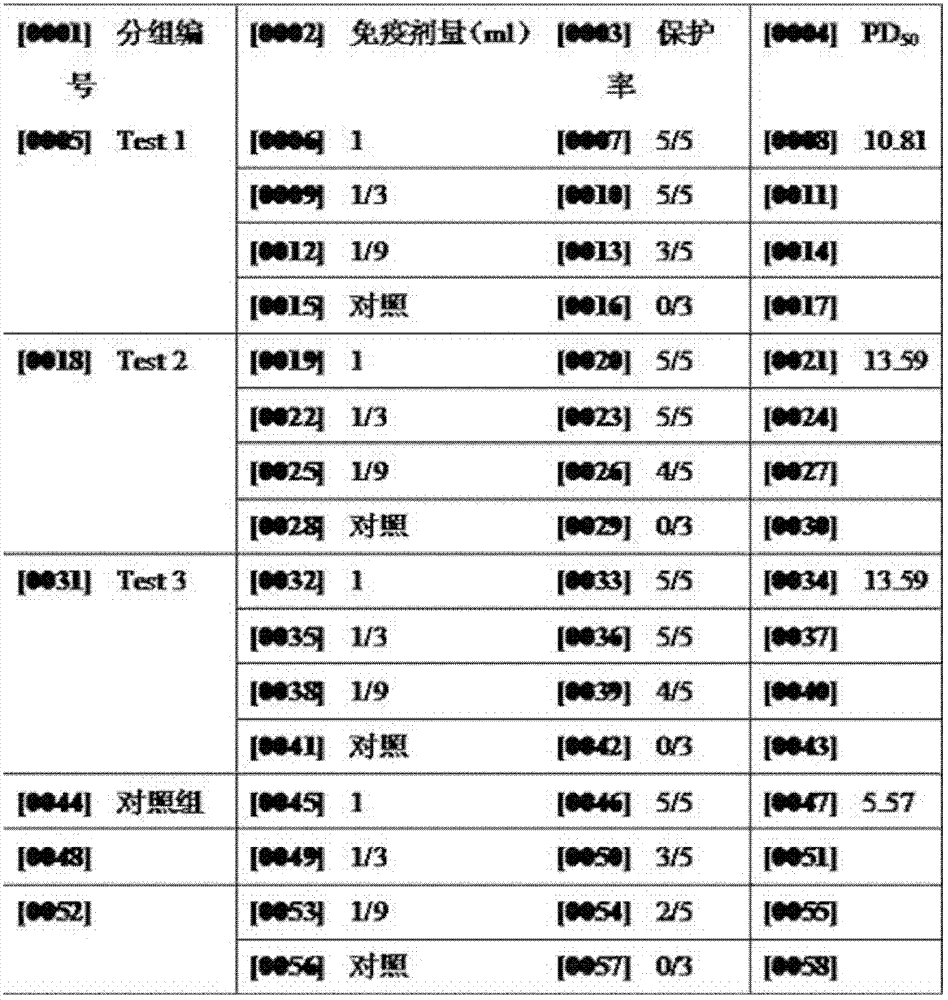
7.3疫苗免疫效力實驗(PD50 )
試驗用牛購自非疫區,並經國家口蹄疫參考實驗室生產的FMD液相阻斷ELISA(LPB-ELISA)檢測A型抗體均<1∶4。FMD非結構蛋白3ABC-ELISA抗體檢測為陰性。該試驗所用動物均嚴格在ABSL-3實驗室圈養。72頭實驗用牛分為4組,對照組是免疫過流行毒A/WH/CHA/09製備的疫苗,實驗組是免疫過重組rA-FMDV毒製備的疫苗,攻毒用毒為10,000倍BID50的流行毒A/WH/CHA/09。攻毒方式為舌麵皮內分多點注射毒液。連續觀察30日,根據牛舌面、齒齦、蹄出現水泡、潰瘍等口蹄疫症狀判定病毒液致牛發病情況,從而判定細胞毒液對牛的毒力情況。免疫效力測定結果表明,重組毒株的PD50在10.81~13.59,而流行毒株製備的疫苗PD50在5.57(表5)。
表5重組毒株與流行毒株PD50 實驗比較表
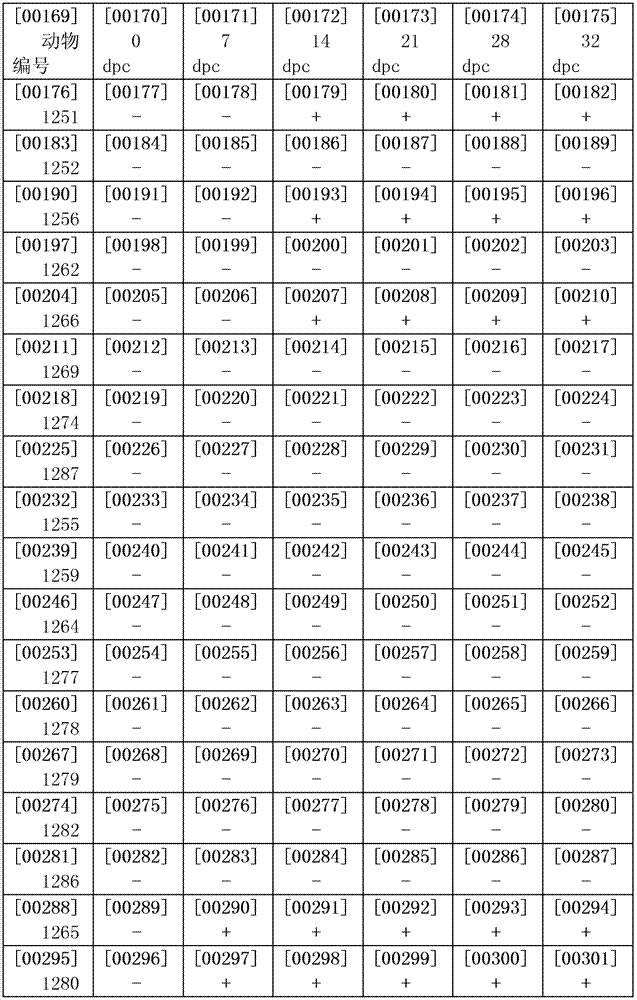
實施例8 .疫苗免疫動物帶毒檢測。
利用非結構蛋白3ABC抗體ELISA和病毒核酸實時定量PCR兩種方法進行監測,其中核酸實時定量採用TaqManPCR方法技術,根據口蹄疫病毒5′-UTR區內部核糖體進入位點保守序列設計合成引物SA-IR-219-246F:5`-CACYTYAAGRTGACAYTGRTACTGGTAC-3;SA-IR-315-293R:5`-CAGATYCCRAGTGWCICITGTTA-3`和探針SAmulti2-P-IR-292-269R:5`-CCTCGGGGTACCTGAAGGGCATCC-3`用於快速、敏感、特異性檢測免疫攻毒後32天的血液、OP液的帶毒情況。結果顯示發病動物能夠產生3ABC抗體,並且能夠監測到病毒核酸。而免疫保護動物不能夠監測到抗體和核酸(表6,7)
表6非結構蛋白3ABC抗體ELISA檢測血清中的抗體結果
dpc:表示免疫攻毒後的天數;+表示為陽性樣品;-表示陰性樣品。
表7:病毒核酸實時定量PCR檢測結果 [00376]7(23.5)14(30.1)28(31)32(33)
+表示為陽性樣品;-表示陰性樣品;數字表示免疫攻毒後的天數,括弧內的數字表示ct值(ct值小於35為陽性樣品)。
《A型口蹄疫重組疫苗株及其製備方法和套用》涉及一種高效反向遺傳技術,用此技術製備效價高、抗原匹配性和免疫保護率高的A型口蹄疫重組疫苗株;以及進一步改良製備出對宿主無致病性的A型口蹄疫重組無致病性疫苗株;同時涉及用製備的疫苗株生產疫苗的方法和套用。所述拯救系統為人工構建的能夠表達精確口蹄疫病毒基因組RNA的高效真核質粒,藉此能夠構建、改良和製備口蹄疫重組病毒。使用上述質粒可以製備出高滴度和抗原匹配性好的疫苗株,A型口蹄疫重組疫苗株製備成滅活苗,免疫豬和牛後可有效刺激機體產生免疫應答,並提供豬和牛體免疫保護作用,對A型AISA拓撲型毒株的10000倍牛半數感染劑量(BID50 )攻毒實驗,免疫保護率達100%,50%保護劑量(PD50 )為10.81~13.59,可用於中國及其周邊國家A型口蹄疫病毒的預防和控制。A型口蹄疫重組無致病性疫苗株,是對宿主無致病性,在宿主體內不複製、不排毒,能夠誘導宿主早期免疫應答的疫苗株,提高了疫苗株的生物安全性和免疫應答能力。
榮譽表彰 2016年12月7日,《A型口蹄疫重組疫苗株及其製備方法和套用》獲得第十八屆中國專利優秀獎。