專利背景 鴨病毒性肝炎 (Duck virus hepatitis,DVH)是由鴨肝炎病毒(Duck hepatitis virus,DHV)感染雛鴨引起的一種急性、高度接觸性傳染病。該病具有發病急、傳播迅速、病程短和死亡率高等特點,其臨床主要表現為死前發生痙攣,頭向背部後仰,呈“角弓反張”,病理變化主要為剖檢可見肝臟腫大和大量的出血性斑點,是危害養鴨業的主要傳染病之一。
鴨肝炎病毒(Duck hepatitis virus,DHV)有三個血清型,即1、2和3型。1型鴨肝炎病毒(DHV-1),又稱鴨A型肝炎病毒(Duck hepatitis Avirus,DHAV),截至2013年1月發現有三種基因型,即:DHAV-1、DHAV-2和DHAV-3,均屬於小RNA病毒科禽肝病毒屬,全球性分布。血清1型鴨肝炎病毒是中國國流行的主要鴨肝炎病毒。
由於鴨病毒性肝炎對雛鴨的發病率、致死率很高且傳播快,極易對養鴨業造成重大經濟損失。預防該病的首要方法是接種鴨病毒性肝炎疫苗,截至2013年1月主要有滅活疫苗和弱毒疫苗兩種。滅活苗是把鴨病毒性肝炎強毒或弱毒經甲醛等滅活後加入不同類型的佐劑混勻後製得,但其免疫效果往往不夠理想且需要多次免疫才能有較好效果,從而影響其臨床使用。弱毒疫苗是將鴨病毒性肝炎病毒在雞胚上連續傳代使其失去了對鴨的致病力但保持了良好的免疫原性。弱毒苗的免疫效果比滅活苗好,產生免疫力快,但研製成本比滅活高、研製周期長。
DHV可在雞胚上經連續傳代變得對雞胚適應而失去了對雛鴨的致病力但保持了良好的免疫原性。病毒在雞胚上所傳代次多少,直接關係著弱毒株作為疫苗株的品質。傳代次數過少,其對雛鴨仍有致病力;傳代次數過多,又影響其免疫原性。因此能夠作為鴨病毒性肝炎弱毒疫苗的候選毒株既要有良好的安全性又要有良好免疫原性。
發明內容 專利目的 《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》所要解決的技術問題是提供一株鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗。
技術方案 《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》的技術方案如下:
一種鴨病毒性肝炎病毒弱毒CH60株,保藏於中國武漢大學的中國典型培養物保藏中心,保藏編號CCTCCNO:V201248。
所述的鴨病毒性肝炎病毒弱毒CH60株製備的弱毒活疫苗。
改善效果 《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》提供的鴨病毒性肝炎病毒弱毒CH60株作為鴨病毒性肝炎弱毒疫苗的毒株,既有良好的安全性,又有良好免疫原性。
技術領域 《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》涉及生物技術領域,尤其涉及的是一種鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗。
權利要求 1.一種鴨病毒性肝炎病毒弱毒CH60株,保藏於中國武漢大學的中國典型培養物保藏中心,保藏編號CCTCCNO:V201248。
2.根據權利要求1所述的鴨病毒性肝炎病毒弱毒CH60株製備的弱毒活疫苗。
實施方式 1.試驗設計
選分離的CH毒株,在9日齡雞胚連傳,每代10枚胚,並觀察每一代雞胚胚體病變情況、死亡時間及死亡率。從F60 -F85 代測定各代的ELD50 和各代毒株的安全性和穩定性。直至獲得符合生產用的毒種。
2.生物安全事項
試驗室設有生物安全櫃、無菌操作室、廢棄污物高壓滅菌消毒櫃。
3.材料
3.1 毒株DHVCH株
由四川農業大學於1990年在四川省某發生鴨病毒性肝炎鴨場的發病雛鴨分離鑑定,為血清1型鴨病毒性肝炎病毒。
3.2 SPF雞種蛋
山東SPAFAS購進。
3.3 1日齡易感雛鴨
上一代種鴨經過ELISA檢測,保證後代仔鴨無DVH母源抗體。
4.試驗方法
4.1 病毒致弱
選CH毒株,在9日齡SPF雞胚連傳60代,每代10枚胚,並觀察每一代SPF雞胚胚體病變情況、死亡時間及死亡率。
4.2 對雞胚的ELD50 測定:
從F60 -F85 代,將胚體毒作10倍系列稀釋,取10、10、10、104個稀釋度的病毒接種9日齡SPF雞胚,每胚0.2毫升,每個稀釋度接種10枚雞胚,一組接種PBS作對照,置37℃溫箱中觀察96小時,24小時內的死胚棄去。記錄雞胚死亡情況,測定DHV(CH株)弱毒的毒價。
4.3 CH60株安全性試驗
1日齡雛鴨36隻均分為3組,一組每隻皮下注射混合毒0.5毫升,二組每隻皮下注射1毫升,三組為空白對照,觀察症狀,於第1、2、3、4和5周齡時每組抽2隻雛鴨剖解,觀察病理變化,取肝臟材料,固定於10%中性福馬林溶液中,按照常規方法製作病理切片,觀察組織顯微變化,評價CH60株安全性。
4.4 CH60株免疫原性測定
1日齡
櫻桃谷鴨 (來源於鴨病毒性肝炎母源抗體陰性種鴨)20隻,隨機分為2組,10隻/組,其中1組每隻腿部肌肉注射CH60弱毒株雞胚混合毒0.2毫升(ELD
50 =10/0.2毫升),2組注射生理鹽水作為對照.接種後7天,對所有鴨進行採血、分離血清和抗Ⅰ-DHV抗體測定,同時每隻鴨肌注1萬倍ELD
50 鴨病毒性肝炎毒,觀察7天,記錄數據。
5.結果評估
①結果判定:根據各代毒株的ELD50 ,安全性試驗,毒力穩定性試驗的結果,並與對照組對比。
②實驗的有效性:如有疑問,試驗至少重複2次,認定試驗的結果的有效。
6.結果
6.1 病毒致弱:許多研究報告指出,DHV在雞胚多次傳代可降低其對雛鴨的致病力,用該法可培育用於制苗的弱毒株。在傳代過程中,第1~4代死亡率為80~97%,到第5代可100%致死雞胚;胚體病變明顯,死亡時間在38~120小時之間;隨著代次增加,雞胚死亡時間逐漸縮短並相對集中,到第50代後基本穩定在32~72小時之間。
6.2 胚體+胚液+尿囊膜混合物對9日齡SPF雞胚的ELD50 為10(F60 -F85 代基本一致,只列F60 代,見下表1)。
6.3 CH60株安全性試驗混合毒每隻皮下注射,觀察5周,結果一、二與三組雛鴨肝臟均無任何眼觀病理變化和顯微變化。
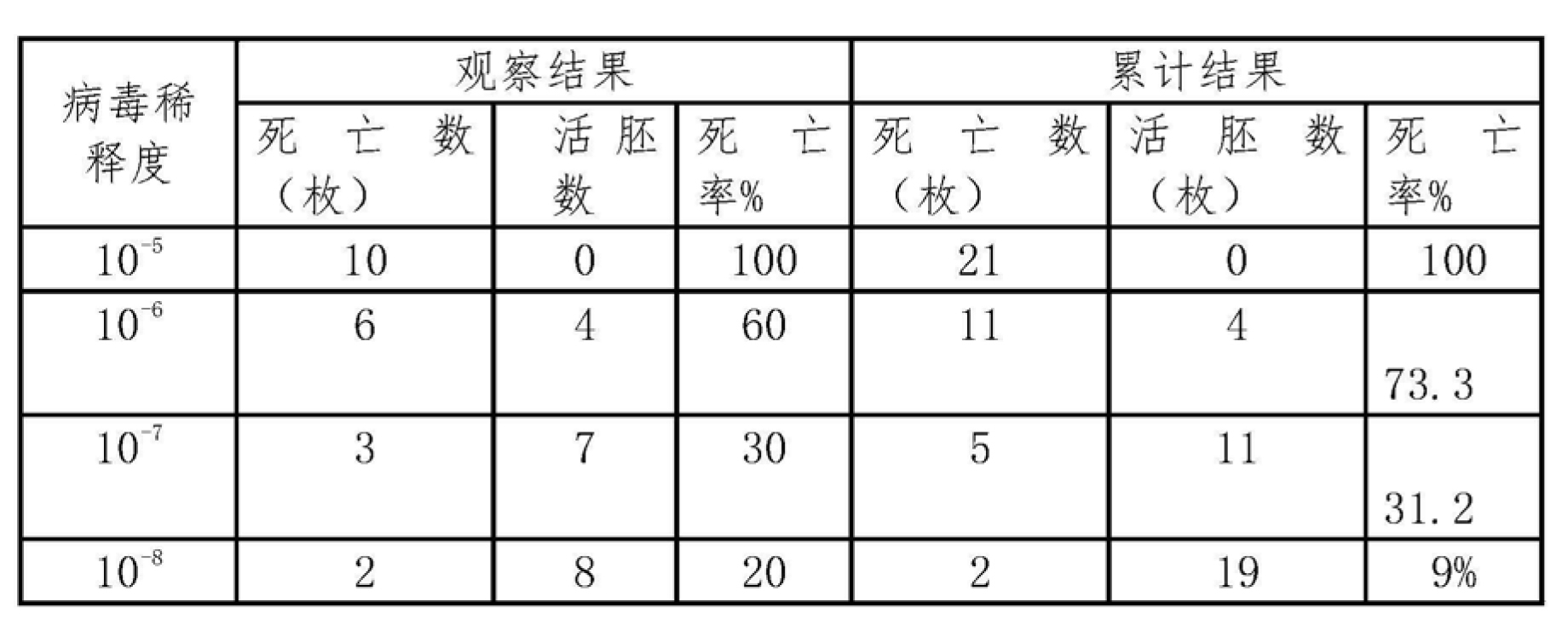
表1DHV(CH60株)各稀釋度雞胚死亡的累計百分率
計算:
距離比例=73.3-50/73.3-31.2=0.55
Log ELD50 =-6+0.55×(-1)=-6.55
則ELD50 =10/0.2毫升,即將病毒懸液作10倍稀釋後,給雞胚接種0.2毫升,可以使50%的雞胚死亡。
6.4CH60株免疫原性測定
10隻CH60弱毒株免疫鴨中和抗體低度分別為2、2、2、2、2、2、2、2、2和2。生理鹽水對照鴨抗體陰性。
肌注1萬倍ELD50 鴨病毒性肝炎病毒CH強毒:疫苗免疫組有1隻出現臨床症狀,4天后逐漸康復,保護率90%(9/10),而生理鹽水對照鴨全部發病,觀察7天內死亡6隻,保護率為零(0/10)。
7結論
DHV在雞胚多次傳代可降低其對雛鴨的致病力,用該法可培育用於制苗的弱毒株。鴨肝炎病毒CH株經SPF雞胚傳60代獲得CH60株。初步測試研究結果表明,CH60株對雛鴨安全,具有良好免疫原性,可以作為生產用毒種,已於2012年11月20日保藏於中國武漢大學的中國典型培養物保藏中心,保藏編號CCTCCNO:V201248,分類命名鴨A型肝炎病毒(Duck Hepatitis A Virus)鴨病毒性肝炎CH60弱毒株。
1.試驗設計
將CH60株毒種接種9~10日齡SPF雞胚尿囊腔,每胚0.2毫升。接種後24小時,每4小時照蛋1次,選接種後36~48小時內死亡的雞胚,製成病毒液,檢驗合格後,加適宜穩定劑,定量分裝,經冷凍真空乾燥,製成生產種子批。註明菌種名稱、凍乾日期,裝量。置-15℃或-80保存。
2.生物安全事項
試驗室設有生物安全櫃、無菌操作室、廢棄污物高壓滅菌消毒櫃、試驗動物設有健康動物房、免疫動物房、攻擊強毒用動物房。
3.材料
3.1 SPF雞種蛋 購自山東SPAFAS。
3.2 鴨病毒性肝炎雞胚化弱毒(CH60株):已於2012年11月20日保藏於中國武漢大學的中國典型培養物保藏中心,保藏編號CCTCCNO:V201248,分類命名鴨A型肝炎病毒(Duck Hepatitis AVirus)鴨病毒性肝炎CH60弱毒株。
3.3 抗鴨病毒性肝炎(Ⅰ-DHV)特異性血清
將購買的商品化弗氏完全佐劑(Sigma公司產品)用於首次免疫。將石蠟油和羊毛脂按體積比為1:5的比例混合,用超音波使之混勻,高溫滅菌,製成不完全弗氏佐劑,用於第二、三次的加強免疫。將弗氏完全或不完全佐劑在研缽中研磨均勻,然後再邊磨邊加入不同量的已純化的DHV-Ⅰ弱毒抗原液(每次抗原用量如下),直至成為均勻的乳白色“油包水”狀態。取一滴該液體置於冰水上3-5分鐘不擴散即可。按常規方法給兔進行三次免疫,第四次進行靜脈注射免疫。
免疫程式:第一次免疫使用弗氏完全佐劑(FCA),抗原終濃度為600微克/毫升,在背部皮下多點注射1毫升;第一次免疫後7-10天后進行第二次免疫,換用弗氏不完全佐劑,抗原終濃度為700微克/毫升,免疫途經和部位同第一次免疫;第二次免疫後7-10天進行第三次免疫,方法同第二次免疫;第三次免疫後7-10天進行第四次免疫,用生理鹽水稀釋抗原蛋白抗原至500微克/1毫升,經耳緣靜脈分多次間隔緩慢注射,1毫升/只。第四次免疫7天以後,用瓊脂擴散法測定血清效價,等瓊擴效價達到1:32及以上時,頸動脈無菌採血分離血清,-20℃保存。
3.4 5%蔗糖牛奶:100毫升脫脂乳中加入5g蔗糖,110℃高壓滅菌。
4.試驗方法
4.1 毒種繁殖將CH60株毒種接種9~10日齡SPF雞胚尿囊腔,每胚0.2毫升。接種後24小時,每4小時照蛋1次,選接種後36~48小時內死亡的雞胚,分別收取胚體。
4.2 對雞胚的毒力將4.1項收穫的毒種用滅菌生理鹽水作10倍系列稀釋,取10、10、10、104個稀釋度,各尿囊腔接種9~10日齡SPF雞胚5個,每胚0.2毫升,置37℃孵化96-120小時。
4.3 製備方法將檢驗合格病毒液按1:1.5比例加入5%蔗糖牛奶,定量分裝,進行冷凍真空乾燥。
4.4 每批數量按200瓶進行規劃。
4.5 無菌檢驗
4.6 支原體檢驗
4.7 外源病毒檢驗
4.8 特異性將F61代毒種用滅菌生理鹽水稀釋至含200ELD50 /0.1毫升,與抗Ⅰ-DHV特異血清混合,置室溫中和1小時後,經尿囊腔接種9~10日齡SPF雞胚10個,每胚0.2毫升,觀察96小時。
4.9 毒種保存將凍乾毒種分別保存在-15℃和-80℃以下,隔1、2、4、6、8和10年取樣進行對雞胚毒力的測定。
4.10 毒種繼代將基礎毒種按4.1項連傳35代,將收穫的病毒用滅菌生理鹽水作10倍系列稀釋,取10、10、10、104個稀釋度,各尿囊腔接種9~10日齡SPF雞胚5個,每胚0.2毫升,置37℃孵化96-120小時。按實施例1中4.2項測定毒種繼代後對雞胚的毒力;並按實施例1中4.4項測定免疫22周成年鴨的中和抗體水平。
5.結果
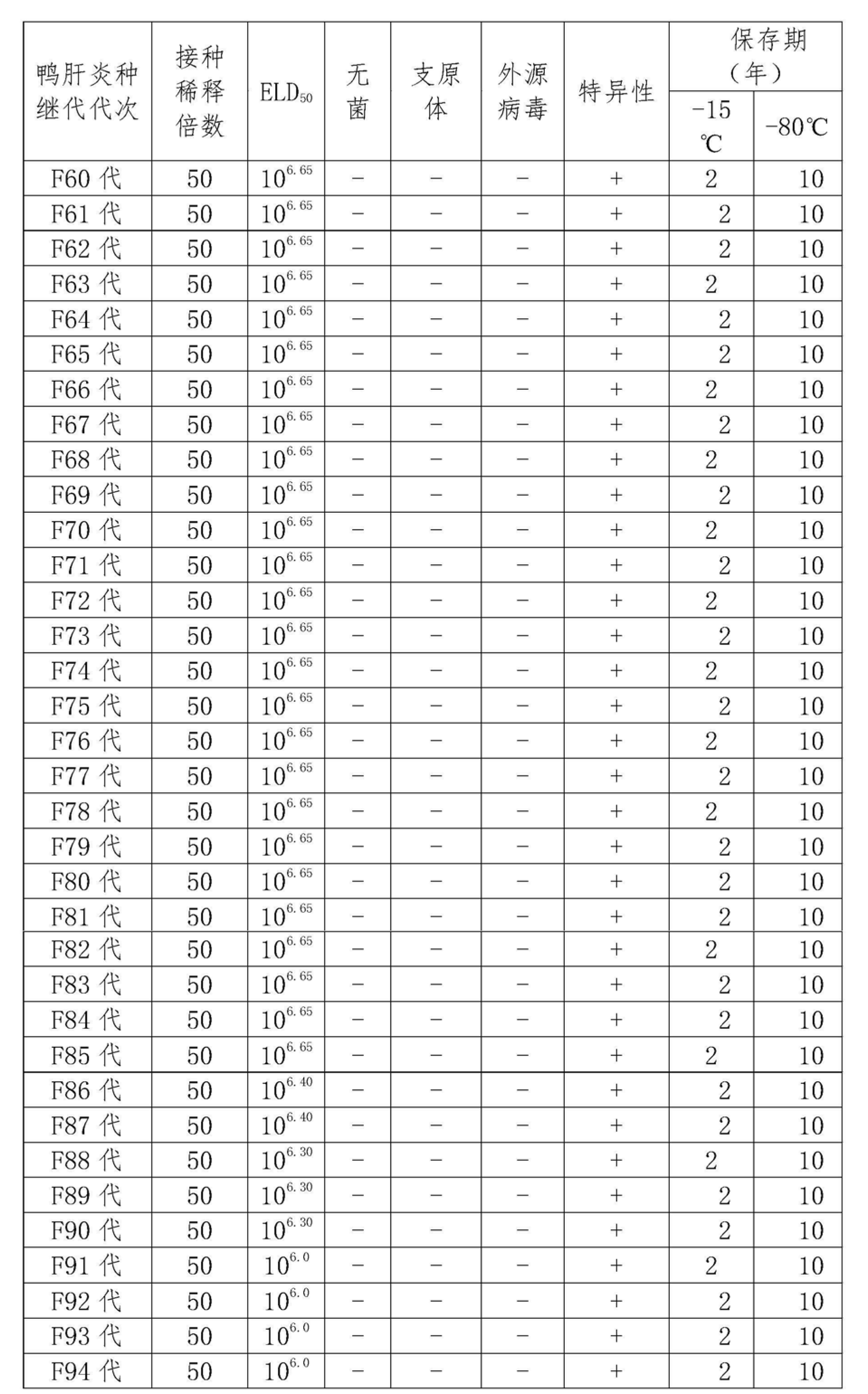
5.1 毒種繼代試驗:對雞胚的毒力試驗表明,F61~F85代在接種後36-92小時內,接種的雞胚出現死亡,每0.2毫升的病毒含量≥106.5ELD50 ,而在F86代後其毒價低於10ELD50 。
鴨病毒性肝炎病毒CH株強毒免疫成年種鴨後誘導鴨體產生中和抗體平均效價為10,CH株的雞胚傳代毒不同代次免疫成年鴨後誘導鴨體產生中和抗體平均效價分別為10(F1)、10(F5)、10(F10)、10(F15)、10(F20)、10(F25)、10(F30)、10(F35)、10(F40)、10(F45)、10(F50)、10(F55)、10(F60)、10(F65)、10(F70)、10(F75)、10(F80)、10(F85)、10(F90)、10(F94)。
將不同代次雞胚傳代毒與原始強毒CH株毒價及免疫原性的結果綜合判斷,因此鴨病毒性肝炎CH60株的繼代次以不超過25代(F85代)為宜(見下表2)。鴨病毒性肝炎病毒CH60株種子批基礎種子繁殖報告見表2。
5.2 純淨檢驗表明:F61~F85代繁殖病毒無細菌、支原體和外源病毒污染(見下表2)。
5.3 特異性檢驗:結果表明,F61~F85代毒種中和後接種的10枚雞胚均不發生特異性死亡(見下表2)。
5.4 毒種保存試驗表明:在-15℃保存,2年以內凍乾毒對10枚雞胚均有致死性毒力,每0.2毫升的病毒含量≥10ELD50 ;在-80℃保存10年以內凍乾毒對10枚雞胚均也有致死性毒力,每0.2毫升的病毒含量≥10ELD50 (可能更長時間,為保證毒價,暫定10年)。(見下表2)。
6.結論
①毒種傳代方法:種毒接種9~10日齡SPF雞胚尿囊腔,每胚0.2毫升。
②毒種保存:在-15℃以下保存,應不超過2年;在-80℃以下保存,應不超過10年。
③毒種製備方法:採用SPF雞胚,收穫毒與蔗糖脫脂乳按1:1.5的重量比例凍乾。
④毒種繼代:F61~F85代。
表2鴨病毒性肝炎病毒CH60株種子批建立試驗
表3鴨病毒性肝炎病毒CH60株種子批基礎種子繁殖報告(只列舉F72批)
1.鴨病毒性肝炎弱毒(CH60株)抗原的製備
①接種將生產用毒種每胚尿囊腔接種0.2毫升,接種後封閉針孔,置37℃繼續孵育,不必翻蛋。
②孵育和觀察接種24小時後,每4小時照蛋1次,直到96小時。取24~96小時死亡的雞胚,置2~8℃冷卻。
③收穫將冷卻4~24小時的雞胚,用無菌手術取絨毛尿囊膜、胎兒、胚液及羊水,每若干個混為一組,置於滅菌瓶中。在收穫的同時,應逐個檢查雞胚,如胎兒腐敗、胚液混濁及有任何污染可疑者棄去不用。
④半成品檢驗。
⑤保存置-15℃以下,保存期不超過3個月。
2.疫苗的製備
①混合抗原的製備將檢驗合格的鴨病毒性肝炎抗原按配苗羽份要求的比例量混合。
②過濾將混合抗原與適量的5%蔗糖脫脂乳混合,在搗碎機中粉碎,並經銅網過濾除去組織雜塊。
③分裝。
④凍乾。
⑤軋蓋。
⑥貼上標籤。
1.生物安全事項
試驗室設有生物安全櫃、無菌操作室、廢棄污物高壓滅菌消毒櫃、試驗動物設有健康動物房、免疫動物房、攻擊強毒用動物房。
2.材料
2.1 鴨病毒性肝炎弱毒活疫苗(CH60株):
批號與數量:2005001(20000羽份/批)、2005002(25000羽份/批)、2005003(24000羽份/批)。
劑型:凍乾
2.2 鴨肝炎病毒CH強毒株。
2.3 28日齡天府肉鴨,來源於不含DVH抗體(經過ELISA檢測)的鴨群。試驗前3天轉移到試驗場。
3.試驗方法和研究指標
3.1 最佳免疫劑量的選擇:將每批疫苗分別作適宜稀釋(1羽份/毫升),選50隻28日齡天府肉鴨,每10隻為1組,共5組,1、2、3和4組分別注射稀釋好的疫苗0.5、1、2和5毫升,第5組作空白對照,免疫後14天,採血、分離血清,作抗DHV中和抗體效價的測定。
3.2 免疫力產生時間的測定:每批疫苗分別選28日齡,不含抗DHV抗體的天府肉鴨40隻,均分2組,隔離飼養,1組每隻鴨均肌注一個免疫劑量,2組為空白對照,1組鴨於免疫後第3、5、7、10和14天分別隨機採集10隻鴨血分離血清,測抗DHV中和抗體效價,對照鴨隨機採集2隻鴨血分離血清,測抗DHV中和抗體效價。詳細觀察記錄臨床表現和精神狀態。
4.結果評估
4.1 結果判定分別記錄每組鴨的中和抗體效價,並與未注射疫苗的對照組進行對比。
4.2 試驗有效性該實驗使用的技術成熟,結果判定指標客觀,整個實驗的各個環節嚴格操作,與對照組進行對比分析和正確評估試驗結果,每組至少套用10隻鴨:該實驗的試驗組20隻,對照組20隻,該試驗認為有效。
5.檔案保存
與動物試驗有關的所有記錄、分析數據,均保存10年。1瓶疫苗在-80℃下至少保存2年。
6.結果
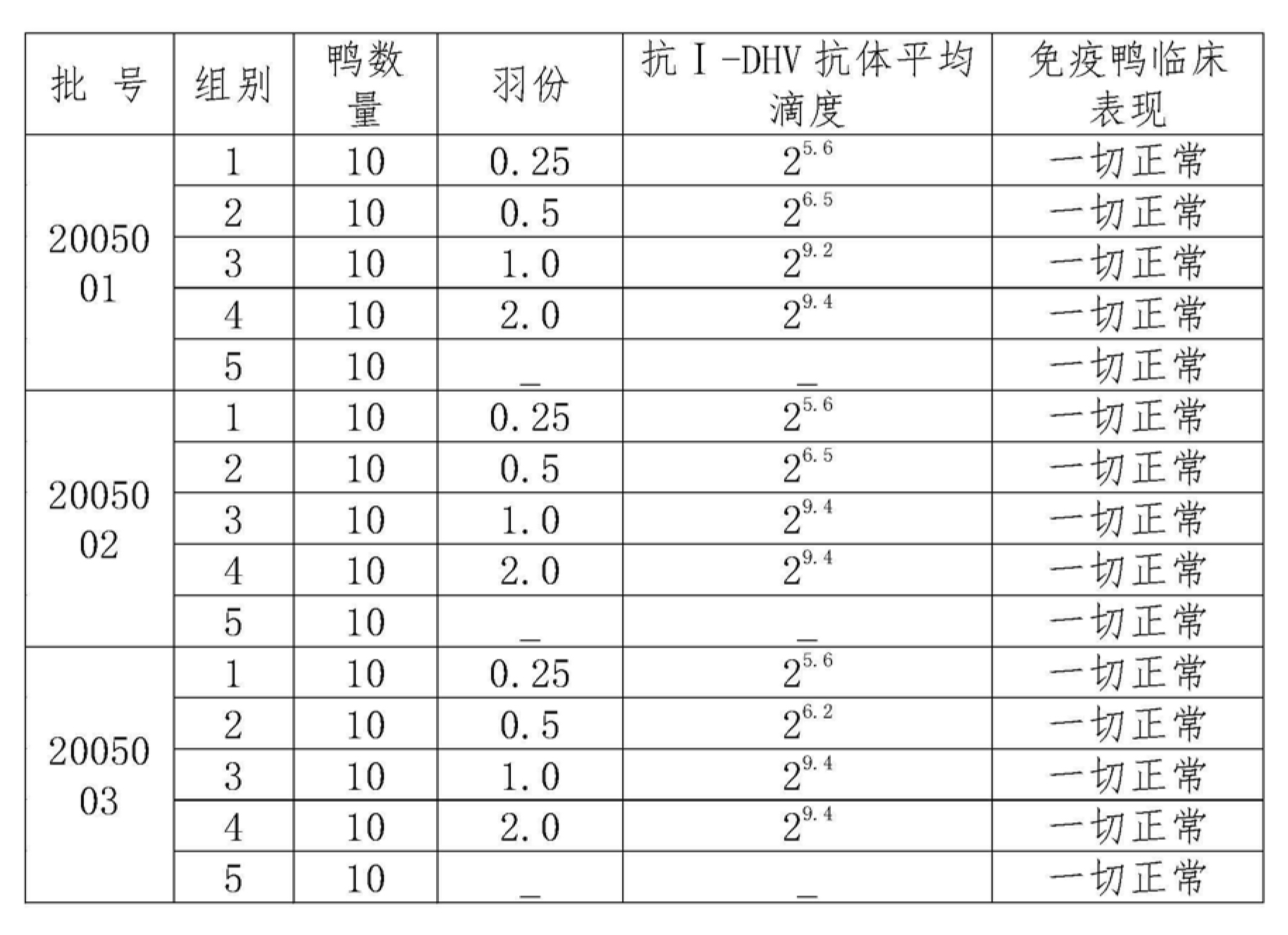
6.1 最佳免疫劑量選擇:結果見下表4,0.5羽份可以使鴨肝炎中和抗體滴度平均2;而以1羽份/毫升(鴨病毒性肝炎弱毒≥10ELD50 )接種後抗鴨肝炎中和抗體平均2,根據P.R.Wooleock(1991)和楊邦玲(1993)的實驗結果,當鴨血清中抗DHV中和抗體滴度達2時,其下一代雛鴨可抵抗DHV強毒的感染,所以疫苗1羽份/毫升肌肉注射,作為臨床套用是比較適宜的。
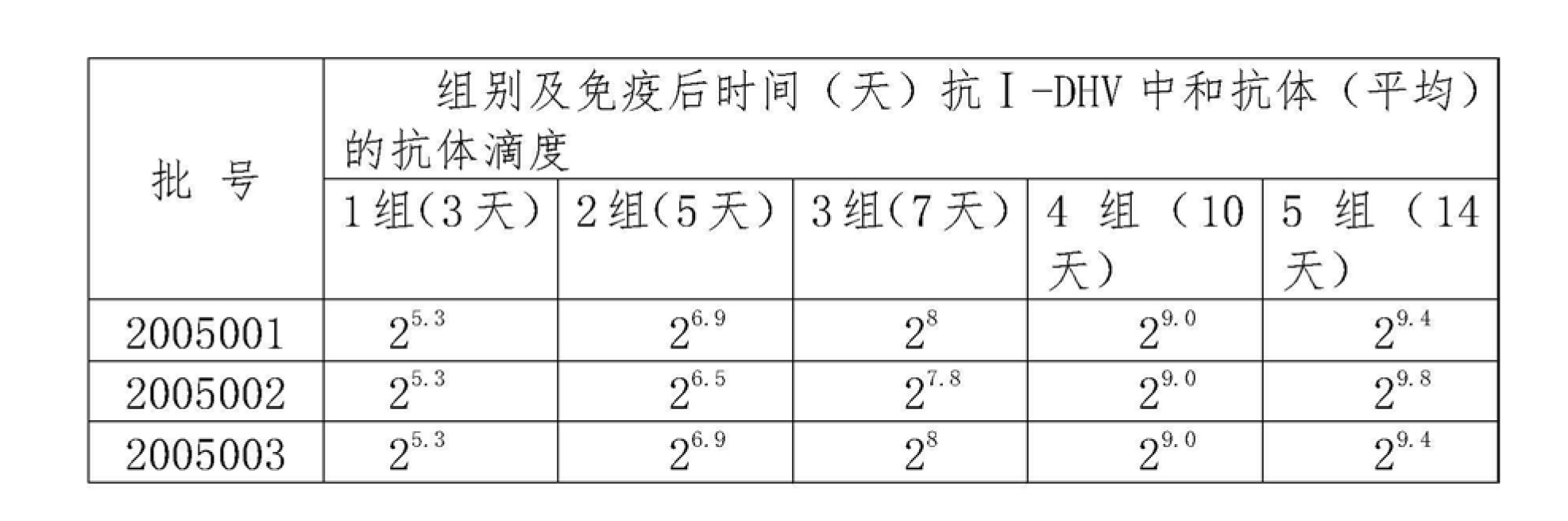
6.2 免疫力產生時間的測定:注射後7天,鴨子即可產生一定免疫力,鴨血清中抗DHV中和抗體達2,第14天時鴨血清中抗DHV中和抗體滴度達2~2,所以疫苗免疫後7天即可產生部分免疫力,到第14天時可產生堅強免疫力(見下表5)。
表4三批疫苗不同免疫劑量免疫鴨後14天血清中抗DHV中和抗體滴度
表5三批疫苗免疫鴨不同時間血清中抗DHV中和抗體滴度
7.結論
疫苗1羽份/毫升肌肉注射鴨,作為臨床套用是比較適宜的。疫苗免疫後7天即可產生部分免疫力,到第14天時可產生堅強免疫力。
1.生物安全事項
試驗室設有生物安全櫃、無菌操作室、廢棄污物高壓滅菌消毒櫃、試驗動物設有健康動物房、免疫動物房、攻擊強毒用動物房。
2.材料
2.1 鴨病毒性肝炎弱毒活疫苗(CH60株):
批號與數量:2005001(20000羽份/批)、2005002(25000羽份/批)、2005003(24000羽份/批)
2.2 試驗動物:10-24周齡非免疫櫻桃谷鴨種鴨,由名山縣養鴨場提供,經過ELISA檢測不含抗DVH抗體。
3.試驗方法和研究指標
3.1 不同抗DVH中和抗體水平種鴨的獲得
選三批鴨病毒性肝炎弱毒活疫苗(CH60株)實驗室產品(2005001、2005002和2005003)進行實驗。
每一批鴨病毒性肝炎弱毒活疫苗(CH60株)以1/6羽份、1/5羽份、1/4羽份、1/2羽份、3/4羽份和1羽份分別免疫24周齡產蛋種鴨,每個劑量免疫50隻,鴨只進行編號,15天採血分離血清測定中和抗體效價,將血清中和抗體效價分別為2、2、2、2、2和2產蛋種鴨各選20隻母鴨(另外配4隻授精用公鴨)為一組,隔離飼養,7天后(目的是讓分群引起的應激情況得到穩定),再次採血分離血清測定中和抗體效價,同時收集當天所產蛋孵化出1日齡雛鴨用於攻擊強毒,以判定種鴨血清中和抗體水平與下一代雛鴨被動免疫保護力關係。
3.2 種鴨抗DVH中和抗體水平與下一代雛鴨被動免疫保護力關係測定
3.2.1 不同抗DVH中和抗體水平種鴨分組
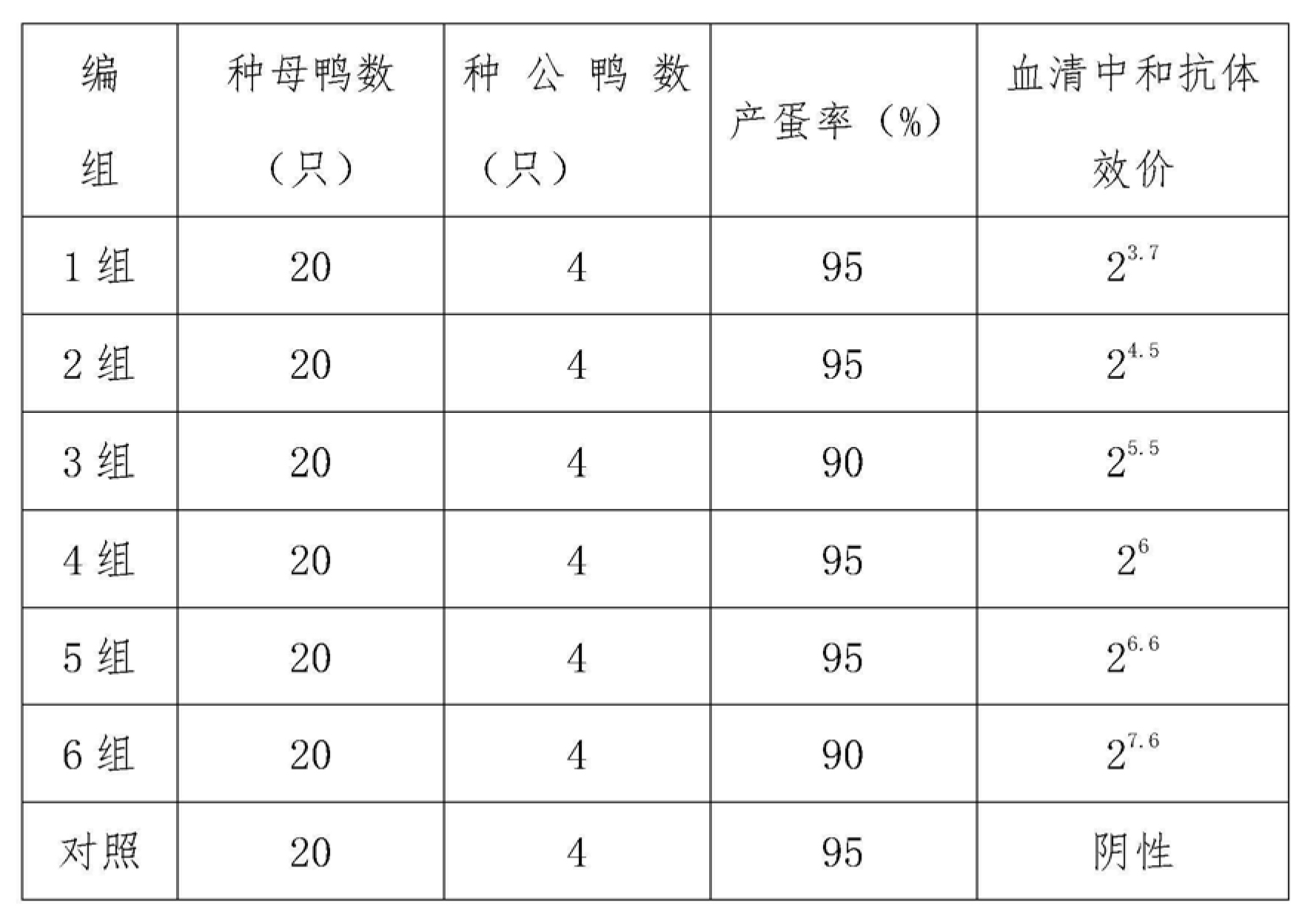
不同抗DVH中和抗體水平種鴨分組情況如下表6。
表6不同抗DVH中和抗體水平種鴨分組情況
3.2.2 不同抗DVH中和抗體水平種鴨與其下一代雛鴨被動免疫保護力關係測定
1-6組種母鴨採血分離血清測定抗Ⅰ-DHV中和抗體效價,同時收集當天所產蛋孵化出1日齡雛鴨用於攻擊1萬倍ELD50 的DHV強毒,觀察10天並作臨床記錄,10日齡稱量體重、剖殺記錄肉眼病變和製作病理切片記錄組織病理學變化。設立非免疫櫻桃谷鴨對照鴨。
4.結果評估
4.1 結果判定:分別記錄每組種母鴨血清中和抗體效價、當天所產蛋孵化出1日齡雛在攻強毒後的死亡情況和肝臟組織病理學變化情況。
保護率=存活並且無肝臟組織病理學變化的雛鴨百分率(%),與對照組進行對比分析。
4.2 實驗有效性:該實驗使用的技術成熟,結果判定指標客觀,整個實驗的各個環節嚴格操作、要正確評估試驗結果,整個實驗未出現異常情況,每組試驗鴨≥10隻,因此認為該試驗有效。
5.檔案保存
與動物試驗有關的所有記錄、分析數據,均保存10年。1瓶疫苗在-80℃下至少保存2年。
6.結果
6.1 2005001批鴨病毒性肝炎弱毒活疫苗(CH60株)實驗結果
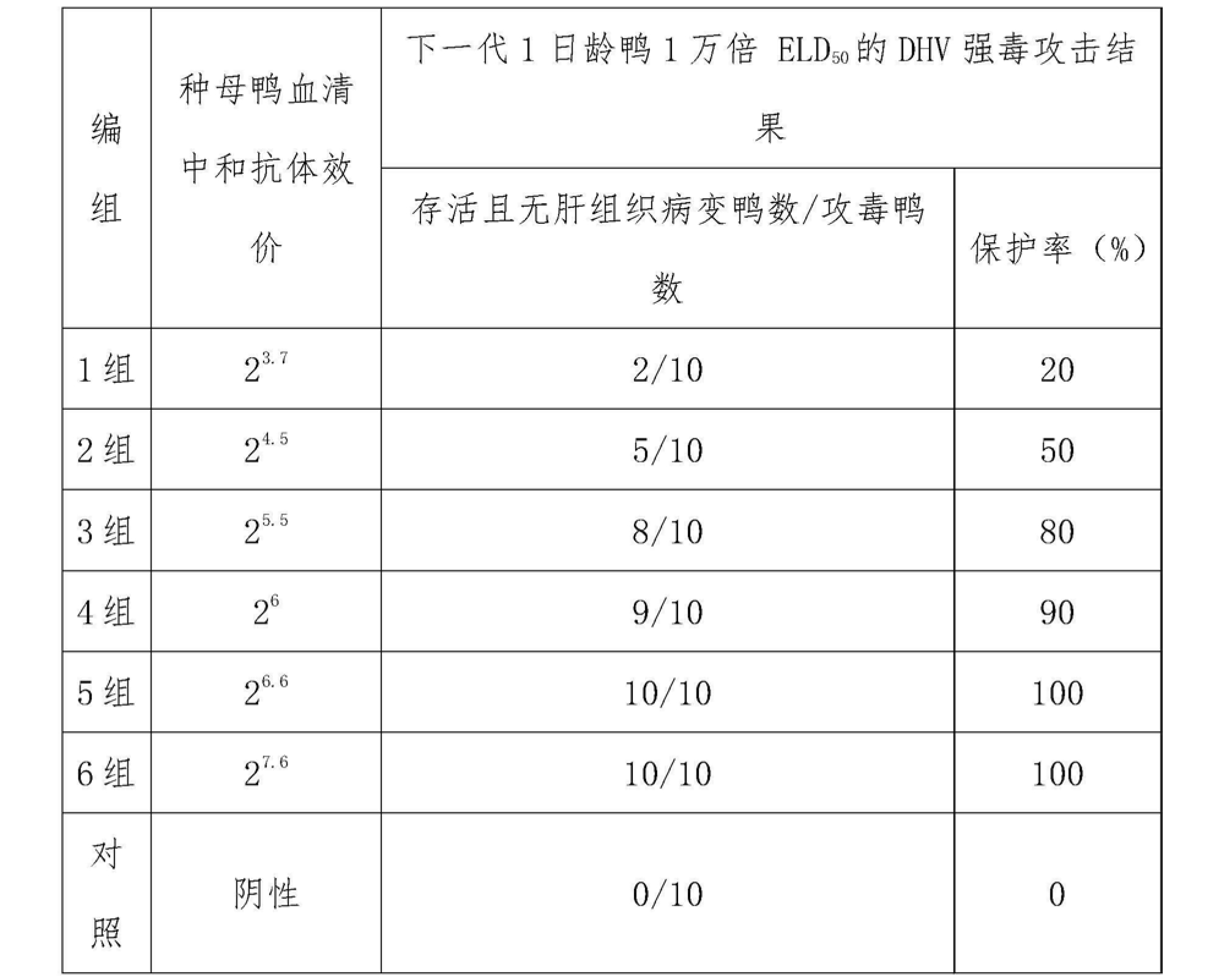
2005001批鴨病毒性肝炎弱毒活疫苗(CH60株)免疫種鴨獲得的不同滴度血清中和抗體效價種鴨,其下一代雛鴨抵抗1萬倍ELD50 的DHV強毒攻擊的結果見下表7。
表7血清不同中和抗體效價種鴨與其下一代雛鴨抵抗1萬倍ELD
50 的DHV強毒攻擊的結果(產品批號:2005001批)
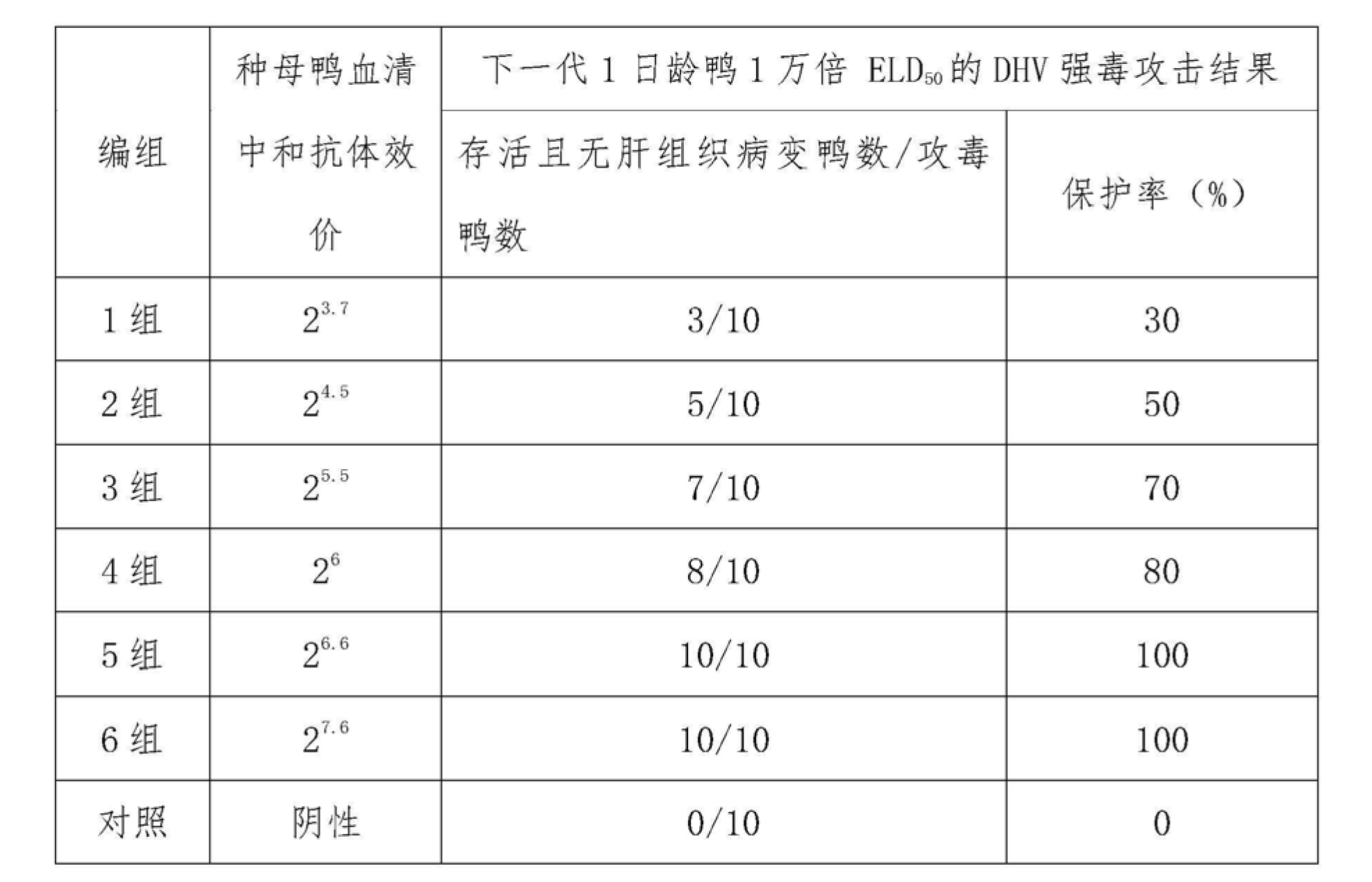
6.2 2005002批鴨病毒性肝炎弱毒活疫苗(CH60株)實驗結果
2005002批鴨病毒性肝炎弱毒活疫苗(CH60株)免疫種鴨獲得的不同滴度血清中和抗體效價種鴨,其下一代雛鴨抵抗1萬倍ELD50 的DHV強毒攻擊的結果見下表8。
表8血清不同中和抗體效價種鴨與其下一代雛鴨抵抗1萬倍ELD
50 的DHV強毒攻擊的結果(產品批號:2005002批)
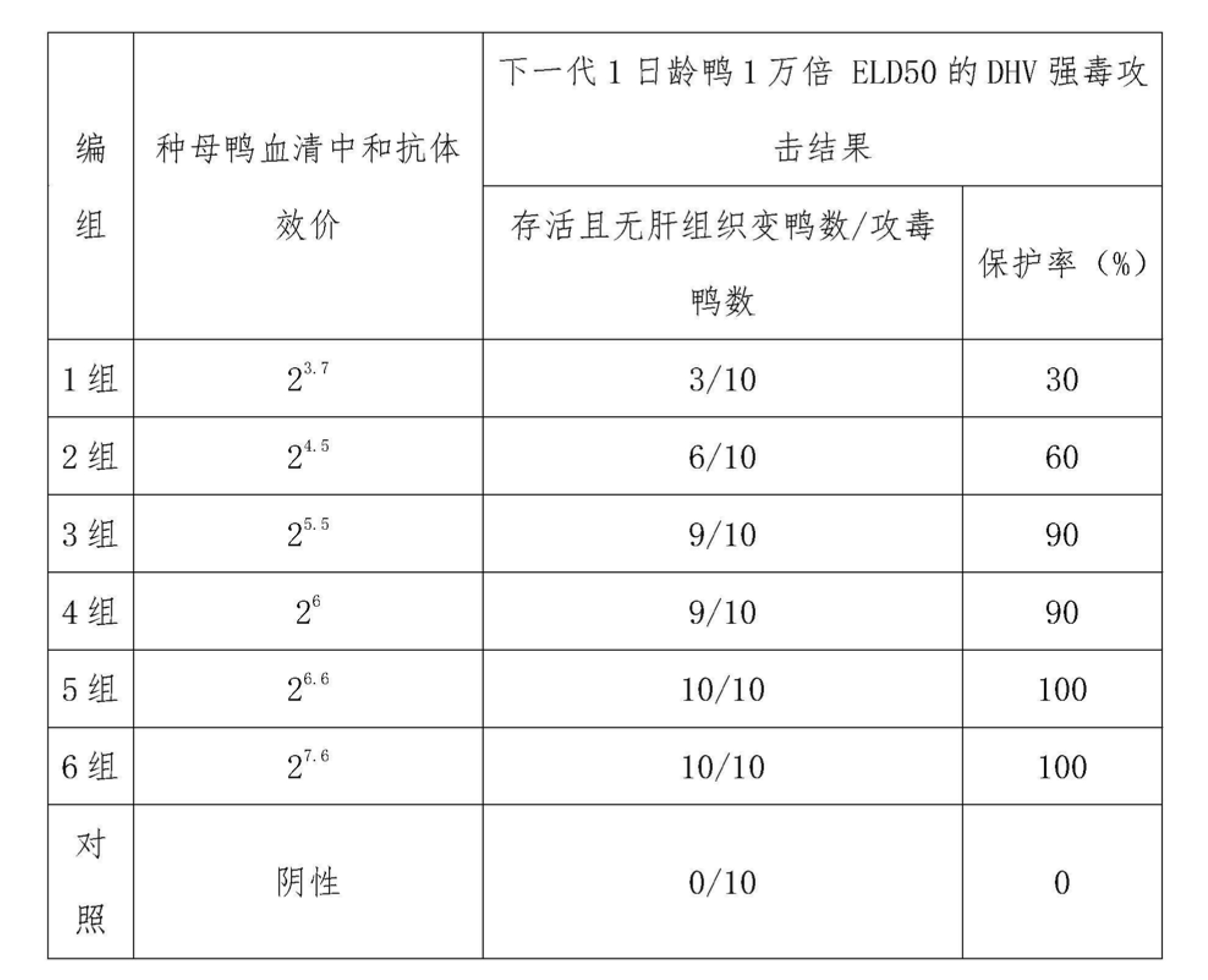
6.3 2005003批鴨病毒性肝炎弱毒活疫苗(CH60株)實驗結果
2005003批鴨病毒性肝炎弱毒活疫苗(CH60株)免疫種鴨獲得的不同滴度血清中和抗體效價種鴨,其下一代雛鴨抵抗1萬倍ELD50 的DHV強毒攻擊的結果見下表9。
表9 血清不同中和抗體效價種鴨與其下一代雛鴨抵抗1萬倍ELD
50 的DHV強毒攻擊的結果(產品批號:2005003批)
7.結論
鴨病毒性肝炎弱毒活疫苗(CH60株)免疫種鴨血清中和抗體效價≥26,其下一代雛鴨可獲得有效被動免疫保護。
應當理解的是,對該領域普通技術人員來說,可以根據上述說明加以改進或變換,而所有這些改進和變換都應屬於《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》所附權利要求的保護範圍。
榮譽表彰 2018年12月20日,《鴨病毒性肝炎病毒弱毒CH60株及其弱毒活疫苗》獲得第二十屆中國專利優秀獎。