《高純度蛇毒纖溶酶的製備方法及其藥物製劑》是北京賽生藥業有限公司於2004年8月16日申請的專利,該專利的申請號為200410009433X,公布號為CN1737133,授權公布日為2006年2月22日,發明人是馬驫、魏化偉、宋夢薇。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》涉及製備高純度蛇毒纖溶酶的方法,將抗原抗體反應與親和層析技術結合,從含蛇毒纖溶酶的原料蛇毒中將蛇毒纖溶酶分離純化,製備得到純度高的蛇毒纖溶酶;還涉及通過該發明方法製備的高純度蛇毒纖溶酶及其藥物製劑,獲得的產品是純度高、集選擇性適度,半衰期長,抗抑制,效力高,無毒副作用於一體的理想溶栓劑。
2016年12月7日,《高純度蛇毒纖溶酶的製備方法及其藥物製劑》獲得第十八屆中國專利優秀獎。
基本介紹
- 中文名:高純度蛇毒纖溶酶的製備方法及其藥物製劑
- 公布號:CN1737133
- 授權日:2006年2月22日
- 申請號:200410009433X
- 申請日:2004年8月16日
- 申請人:北京賽生藥業有限公司
- 地址:北京市經濟技術開發區興盛街8號
- 發明人:馬驫、魏化偉、宋夢薇
- Int.Cl.:C12N9/48(2006.01)、C12N9/68(2006.01)、C07K16/40(2006.01)、C12N5/18(2006.01)、A61K38/48(2006.01)等
- 代理機構:北京律誠同業智慧財產權代理有限公司
- 代理人:黃韌敏、徐金國
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,附圖說明,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
截至2004年8月,在人類疾病中,心血管疾病的發生率和死亡率均占首位,而其中血栓栓塞性疾病可使患者生命質量下降或死亡。血栓栓塞性疾病主要包括三種類型:導致心肌梗塞的冠狀動脈疾病,引起中風的腦血管疾病和易於引起肺栓塞的靜脈血栓疾病。這些疾病都是由關鍵部位的血管里的血栓導致重要器官缺血引起的。溶栓性藥物是治療這些疾病的首選藥物。
溶栓藥經過幾十年的的研究,大致可以分為三個階段。
第一代PgA(纖維蛋白溶酶原激活劑)
主要由鏈激酶SK和尿激酶u-PA組成。第一代PgA雖然具有一定的溶栓效應,但存在著很多缺陷。表現為:
1)在體內半衰期很短,需要連續注射方可達到治療目的。因此,具有較多副作用,如使用u-PA進行治療時,幾乎無一例外地導致了抗凝狀態的形成。
2)注入體內後易產生抗體,成為藥物本身的抑制劑,限制了溶栓作用的發揮,甚至導致出血綜合症和促發SK介導的血小板凝集。
3)纖維蛋白選擇性差,除激活血栓中的Pg(纖維蛋白原)外,還同樣激活血液中的Pg,從而激活了纖溶系統,使得凝血系統嚴重受損。
第二代PgA
以組織型纖溶酶原激活劑(t-PA)、單鏈尿激酶型纖溶酶原激活劑(scu-PA)和甲醯化纖溶酶原一鏈激酶複合物(APSAC)為代表。與第一代PgA顯著不同的是,第二代PgA具有很高的纖維蛋白選擇性。因此,它在血栓中的局部纖溶作用強。但第二代PgA仍然存在著一些缺點和不足:
1)t-PA和scu-PA在體內的半衰期很短,只有連續注射方可達到治療目的。為儘快溶解冠狀動脈血栓所需的劑量,足以引起Pg及Fg的大量損耗,從而導致出血傾向。
2)臨床觀察,治療後疏通的血管易出現再次堵塞。
3)APSAC半衰期雖較長,但如果給藥太快會引起低血壓和系統性纖溶系統的激活。
近年來,在上述溶栓劑的基礎上,針對其不足加以改進,用分子生物學和化學方法研製了一些PgA的突變體、嵌合體、單抗和PgA的結合體,取得了一定的效果,但價格昂貴,而溶栓治療中仍會碰到以下一些問題:
1)20%-30%的急性心肌梗塞病人對溶栓藥物無反應,且對於陳舊性血栓的治療效果均不理想。
2)5%的病人出現急性再堵塞。
3)死亡率仍然很高,達10%。
4)顱內出血的發生率為1%。
5)對於半衰期短的溶栓劑,治療時需要頻繁給藥,使治療成本較高。
第三代溶栓劑——纖溶酶
二十世紀五十年代中期Didisheim和Lewis報導了在許多蛇毒中發現纖溶活性,第一次提出蛇毒纖維蛋白溶解酶對人血清蛋白酶抑制因子是不敏感的理論,為用純化蛇毒酶來溶解病理條件下的人血凝塊奠定基礎。
在人體內注射纖溶酶後,它專一地裂解纖維蛋白Aα-鏈的lys-leu鍵,從而起到溶栓的作用,試驗證明,纖溶酶在體外或體內都有良好的溶栓效果。同時,在臨床上,至今未發現其有出血現象,這是因為纖溶酶具有高度的底物專一性。套用胰島素氧化β鏈和人工合成的八肽查明了決定這些酶對lys-leu鍵專一裂解的原因。結果表明,與其它酶一樣,決定其裂解位點的是序列決定性,而非鍵決定性。至少與lys-leu周圍的八個胺基酸順序有關。
發明內容
專利目的
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的一個目的在於提供一種高純度蛇毒纖溶酶的製備方法,利用免疫親和層析法製備得到了高純度的蛇毒纖溶酶。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的另一目的在於提供使用該發明方法製備的高純度蛇毒纖溶酶。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的再一目的在於提供含有該發明的高純度蛇毒纖溶酶的藥物製劑。
技術方案
根據《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的一方面,製備高純度的蛇毒纖溶酶的方法,包括以下的步驟:
1)含有蛇毒纖溶酶的蛇毒原料初步純化、分離,獲得主要成分為蛇毒纖溶酶的活性組分1;
2)將所述的活性組分1進一步純化,得到活性組分2;
3)將所述的活性組分2作為抗原,製備抗蛇毒纖溶酶特異性抗體;
4)將所述製備得到的蛇毒纖溶酶特異性抗體與親和層析載體結合,製備抗體親和層析柱;
5)以所述的抗體親和層析柱純化步驟1)的活性組份1,獲得高純度蛇毒纖溶酶。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的方法中,將抗原抗體反應與親和層析技術結合,從含蛇毒纖溶酶的原料蛇毒中將蛇毒纖溶酶分離純化,製備得到純度高的蛇毒纖溶酶。該方法中,首先需製備獲得針對蛇毒纖溶酶的特異性抗體,再將該特異性抗體與適宜的親和層析載體結合,製備成抗體親和層析柱,利用該抗體親和層析柱可對原料進行純化,製備高純度的蛇毒纖溶酶。
在《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中,針對蛇毒纖溶酶的特異性抗體可以採用多種方法製備,在《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的一個具體實施方案中,首先以蛇毒纖溶酶為抗原免疫小鼠,獲得含抗蛇毒纖溶酶抗體的小鼠抗血清,同時將該蛇毒纖溶酶與親和層析載體結合,製備成抗原親和層析柱,將小鼠抗血清上抗原親和層析柱,利用結合於親和層析載體上的抗原蛋白與血清中的抗體特異結合,獲得純化的特異性抗體。此外,也可以採用單克隆抗體技術來製備《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的蛇毒纖溶酶的特異性抗體,例如,將經蛇毒纖溶酶免疫後的小鼠脾細胞與骨髓瘤細胞融合,獲得雜交瘤細胞,篩選分泌蛇毒纖溶酶抗體的雜交瘤細胞建株,由此可獲得穩定的蛇毒纖溶酶的特異性抗體。
將製備獲得的抗蛇毒纖溶酶特異性抗體與適宜的親和層析載體結合,製備成抗體親和層析柱,使用該抗體親和層析柱即可對原料進行分離純化,製備高純度的蛇毒纖溶酶。
在《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中,為了獲得高純度的蛇毒纖溶酶,可以採用對原料進行分步純化的方法,例如,在《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的一個具體實施方案中,首先將原料蛇毒進行透析截留一定分子量的成分,然後將獲得的樣品通過離子交換層析進行初步純化,獲得活性組分1,該活性組分1再經《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的抗體親和層析柱純化,即可獲得高純度的蛇毒纖溶酶。
用作抗原的蛇毒纖溶酶最好使用純度較高的蛇毒纖溶酶,在《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中,該用作抗原的蛇毒纖溶酶可以通過將上述初步純化的活性組分1進一步經過製備型高效液相色譜的分離而獲得,這樣獲得的蛇毒纖溶酶(活性組分2)可以用作免疫小鼠的抗原和製備抗原親和層析柱的抗原使用。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中用作親和層析柱的載體的材料可以使用各種適宜的載體材料,優選的載體材料可以使用多糖基質,例如:Sepharose4B瓊脂糖凝膠、二乙氨基葡聚糖凝膠或羧甲基葡聚糖凝膠,在使用前可以先將載體活化,《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的實施方案中,使用溴化氰作為活化劑,將製備得到的抗原或特異性抗體偶聯到活化了的載體上,即可製備抗原親和層析柱與抗體親和層析柱。
按照《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的另一方面,提供通過《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法製備的高純度蛇毒纖溶酶,其具有以下的特性:比活性為每毫克蛋白5000單位以上;高效液相色譜法分析,單組分圖譜,主峰面積大於95%,保留時間為8.3±0.5分鐘;SDS-聚丙烯醯胺凝膠電泳顯示一條帶,分子量為31000±2000道爾頓。
根據《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的再一方面,提供《高純度蛇毒纖溶酶的製備方法及其藥物製劑》高純度的蛇毒纖溶酶藥物製劑,按照藥品管理辦法和藥品生產質量管理規範的要求,由蛇毒纖溶酶為藥效成份,添加藥學上可接受的藥用輔料製備得到適於臨床套用各種藥物製劑,這些製劑的劑型包括但不限於纖溶酶注射液、注射用纖溶酶、靜脈注射用纖溶酶注射液、凍乾靜脈注射用纖溶酶等。
改善效果
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》將傳統的提純工藝和免疫親和層析技術相結合,從蝮蛇蛇毒中純化出一種纖溶酶。並利用該原料藥做成可供肌注、靜脈注射及靜脈輸液等多種途徑給藥的製劑。該項技術的特點是酶的專一性強,經高效液相色譜檢查為單一組分,在SDS-聚丙烯醯氨凝膠電泳上顯示一條帶,經臨床實驗證明,該產品在溶栓治療中有著獨特的療效,克服了第一代和第二代PgA存在的缺點和不足,是溶栓藥物的一個新的里程碑。表現為:
1)可以直接作用於形成血栓的纖維蛋白,將其降解,並對陳舊性血栓有獨特的療效。
2)在體內可降解血漿纖維蛋白原,降低血液粘度,拮抗凝血酶,從而降低高血壓、動脈粥樣硬化、缺血性心臟病的發病率。
3)在體內的半衰期較長,實驗證明,給藥24小時取血,血液學指標(如血漿纖維蛋白原含量、血漿粘度等)仍可明顯改變。
4)對體內纖溶系統無明顯激活作用,因此不具有出血傾向,避免了併發症的發生。
5)由於該品純度高,因此毒副作用大大降低,使用更安全。
6)有很強的底物專一性,作用迅速,療效好。
綜上所述,《高純度蛇毒纖溶酶的製備方法及其藥物製劑》提供的蛇毒纖溶酶是集選擇性適度,半衰期長,抗抑制,效力高,無毒副作用於一體的理想溶栓劑。
附圖說明
圖1為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中製備活性組分1的陰離子交換柱層析紫外吸收圖譜;
圖2為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中抗蛇毒纖溶酶特異性抗體純化過程記錄儀圖譜;
圖3為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》方法中製備高純度蛇毒纖溶酶的親和層析流程記錄儀圖譜;
圖4為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》高純度蛇毒纖溶酶SDS-聚丙烯醯胺凝膠電泳圖譜;
圖中:泳道1、2、4、5、6、7、9、10為蛇毒纖溶酶;其中,1、4、9為纖溶酶樣品040312,2、5、10為纖溶酶樣品040315,6、7為纖溶酶樣品040317,泳道3、8為低分子量標準蛋白(其組成為兔磷酸化酶B97400,牛血清白蛋白66200,兔激動蛋白43000,牛碳酸酐酶31000,胰蛋白酶抑制劑20100,雞蛋清溶菌酶14400)。
圖5為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》製備的高純度蛇毒纖溶酶高效液相色譜圖譜;
圖6為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》製備的另一批次的高純度蛇毒纖溶酶高效液相色譜圖譜;
圖7為《高純度蛇毒纖溶酶的製備方法及其藥物製劑》製備的又一批次的高純度蛇毒纖溶酶高效液相色譜圖譜。
技術領域
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》涉及高純度的蛇毒纖溶酶的製備方法,更具體地說是涉及採用免疫層析法製備高純度的蛇毒纖溶酶。
《高純度蛇毒纖溶酶的製備方法及其藥物製劑》還涉及用該發明方法製備的蛇毒纖溶酶及其製劑。
權利要求
1、製備高純度蛇毒纖溶酶的方法,包括下述步驟:
1)將含蛇毒纖溶酶的蛇毒原料初步純化、分離獲得主要成分為蛇毒纖溶酶的活性組分1;
2)所述活性組分1進一步純化獲得活性組分2;
3)將活性組分2作為抗原,製備抗蛇毒纖溶酶特異性抗體;
4)將所述製備得到的抗蛇毒纖溶酶特異性抗體與親和層析載體結合,製備抗體親和層析柱;
5)用所述抗體親和層析柱分離純化步驟1)中的活性組分1,獲得高純度蛇毒纖溶酶。
2.權利要求1所述的方法,其特徵在於步驟3)中所述製備抗蛇毒纖溶酶特異性抗體包括下述步驟:
3a)以所述活性組分2作為抗原,免疫小鼠,製備抗血清;
3b)將所述活性組分2與親和層析載體結合,製備抗原親和層析柱;
3c)將所述抗血清上抗原親和層析柱,分離得到抗蛇毒纖溶酶特異性抗體。
3.權利要求1所述的方法,其特徵在於步驟3)中所述製備抗蛇毒纖溶酶特異性抗體包括下述步驟:
3i)以所述活性組分2作為抗原,免疫小鼠,製備免疫小鼠脾細胞;
3ii)將所述免疫小鼠脾細胞與小鼠骨髓瘤細胞融合,製備融合的雜交瘤細胞;
3iii)篩選表達抗蛇毒纖溶酶抗體的雜交瘤細胞,建立細胞株;
3iv)培養所述細胞株獲得所述抗蛇毒纖溶酶特異性抗體。
4.權利要求1、2或3所述方法,其特徵在於步驟1)所述蛇毒原料初步純化、分離包括下述步驟:
1a)將蛇毒原料經透析,截留分子量10000以上部分;
1b)將上述截留部分經DEAE-Sepharose離子交換柱吸附,以0.02摩爾/升pH7.8的Tris-HCl緩衝液洗脫未吸附的雜蛋白後,分別用0.02摩爾/升的Tris-HCl含0.05摩爾/升和0.115摩爾/升氯化鈉的緩衝液進行梯度洗脫,收集活性峰,製備活性組分1。
5.權利要求1、2或3所述方法,其特徵在於所述親和層析載體為Sepharose4B瓊脂糖凝膠、二乙氨基葡聚糖凝膠或羧甲基葡聚糖凝膠。
6.權利要求1、2或3所述的方法,其特徵在於所述步驟2)中進一步純化活性組分1的方法為將活性組分1經製備型高效液相色譜分離,製備蛇毒纖溶酶,即為活性組分2。
7.權利要求1方法制各的高純度蛇毒纖溶酶。
8.權利要求7所述的高純度蛇毒纖溶酶,其特徵在於所述高純度蛇毒激肽原酶具有以下特性:
比活性為每毫克蛋白5000單位以上;
高效液相色譜法檢測,單組分圖譜,主峰面積大於95%,保留時間為8.3±0.5分鐘;
SDS-聚丙烯醯胺凝膠電泳上顯示一條帶,分子量為31000±2000道爾頓;
9.一種藥物製劑,含有權利要求7所述高純度蛇毒纖溶酶以及藥學上可接受的藥用輔料。
10.權利要求9所述的藥物製劑,其特徵在於所述藥物製劑為靜脈給藥劑型。
實施方式
一、高純度的蛇毒纖溶酶的製備
1、蛇毒粗品的處理
準確稱取蝮蛇蛇毒(遼寧清源蛇廠生產),用0.02摩爾/升pH7.8的Tris-HCl緩中液將其充溶解,然後以4000轉/分鐘離心20分鐘取上清,沉澱用少量的緩衝液再次離心取上清,合併上清液裝透析袋(截留分子量為10000以上的組分)對0.02摩爾/升pH7.8的Tris-HCl緩中液透析12小時備用。
2、離子交換層析純化
透析過的樣品以6.0毫升/分鐘的流速上陰離子交換柱(DEAE-Sepharose),然後用0.02摩爾/升pH7.8的Tris-HCL緩衝液洗脫未吸附的雜蛋白,透過峰下到基線時,用含0.05摩爾/升和0.2摩爾/升氯化鈉的0.02摩爾/升Tris-HCL緩衝液進行梯度洗脫,收集活性峰,製得活性組分1。活性組分1的主要成分為蛇毒纖溶酶,具蛇毒纖溶酶活性,根據SDS-聚丙烯醯胺凝膠電泳的主要條帶計算的分子量與蛇毒纖溶酶吻合;此流程用280納米紫外檢測儀檢測,同時用記錄儀記錄,如圖1所示。
3、用作抗原的蛇毒纖溶酶的製備
將離子交換層析收集的活性組分1濃縮用截留分子量為10000的透析袋對聚乙二醇濃縮,用製備型高效液相色譜分離,分別收集活性組分,並定性,得纖溶酶(活性組分2),其具蛇毒纖溶酶活性,SDS-聚丙烯醯胺凝膠電泳顯示為一條帶,計算的分子量與蛇毒纖溶酶標準品吻合;HPLC檢測為單一組分,保留時間與蛇毒纖溶酶標準品吻合。
4、抗原親和層析的製備
稱2克經溴化氰活化的Sepharose-4B,加300毫升1摩爾/升的HCL充分攪拌使之膨脹,另取30毫克上述活性組分2溶於0.1摩爾/升Na2CO3(含0.5摩爾/升NaCL)pH8.3緩衝液中。將上述Sepharose-4B與活性組分2溶液混合,在室溫攪拌2h,用0.1摩爾/升pH8.3Na2CO3(含0.5摩爾/升NaCL)緩衝液充分洗滌後,再用0.1摩爾/升Tris-HCL緩衝液(pH8.30)再洗一次,加同一緩衝液,於室溫攪拌過夜。裝柱,製備得到抗原親和層析柱。
5、小鼠抗血清製備
用上述活性組分2(50~500微克/毫升)與等體積完全佐劑混合乳化作為刺激物,對7周齡的BALB/c小鼠(中檢所實驗動物中心)皮下注射免疫,每次0.2毫升,每周1次,共免疫4~6次。在採集血親前3天取0.2毫升刺激物小鼠尾靜脈注射加強免疫。
6、製備抗蛇毒纖溶酶特異性抗體
取上述免疫小鼠血清,將血清樣品上抗原親和層析柱,用結合在凝膠上的抗原蛋白與樣品中的抗體特異性結合,純化得到特異性抗體。具體步驟為:用平衡液(0.05MTris-HCL緩衝液,pH=7.8)平衡抗原親和層析柱後,將血清樣品上抗原親和層析柱,用平衡液平衡至流出液在蛋白檢測儀上繪出穩定的基線後,用洗脫液(0.02MTris-HCL緩衝液,pH=7.8,含0.5MNacl,7%Arg)洗脫,收集活性組分,如圖2所示。將收集到的活性組分用透析袋(截留分子量為10000,對聚乙二醇濃縮)濃縮後,冷凍乾燥,即為抗蛇毒激肽原酶特異性抗體。
7、抗體親和層析柱的製備
以Sepharose4B瓊脂糖凝膠、二乙氨基葡聚糖凝膠或羧甲基葡聚糖凝膠作為親和層析的載體,用溴化氰活化該載體;取100毫克上述製備的特異性抗體溶於20毫升硼酸緩衝液中,過濾,濾液加至活化的載體中,在10℃下攪拌反應18小時,次日裝柱,用10倍柱體積的pH10.2硼酸緩衝液以5~6毫升/分鐘流速洗滌柱體,收集流出液,然後再依次用5倍柱體積的pH10.00.1摩爾/升的乙醇胺溶液及0.1摩爾/升的硼酸緩衝液(pH8.0)充分洗滌,最後用pH7.4的0.1摩爾/升磷酸緩衝液洗滌平衡,即得到抗體親和層析柱。該柱可重複使用200次以上,用20%的乙醇可長期保存。
8、高純度蛇毒纖溶酶的製備
將上述離子交換層析得到的活性組分1用親和層析平衡緩衝液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl)溶解,上抗體親和層析柱,用該緩衝液平衡至流出液在蛋白檢測儀上繪出穩定的基線後,用含有洗脫劑的親和層析洗脫液洗脫(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl,7%Arg)。收集活性峰,如圖3所示,並測定效價,冷凍乾燥後即為蛇毒纖溶酶原料藥。滿足高純度纖溶酶性能評定標準。
- 實施例1 免疫抗體親和層析柱的製備
用高效液相色譜純化並經定性的蛇毒纖溶酶(活性組分2)100微克/毫升與等體積完全佐劑混合乳化作為刺激物,對7周齡的BALB/c小鼠皮下注射免疫,每次0.2毫升,每周1次,共免疫5次。在採集血清前3天取0.2毫升刺激物小鼠尾靜脈注射加強免疫。用抗原親和層析柱純化抗體。
用溴化氰活化4B-Sepharose瓊脂糖凝膠,把得到的蛇毒纖溶酶抗體偶聯到多糖基質上,從而製成免疫親和層析柱。
- 實施例2 免疫抗體親和層析柱的製備
用高效液相色譜純化並經定性的蛇毒激肽原酶(活性組分2)200微克/毫升與等體積完全佐劑混合乳化作為刺激物,對7周齡的BALB/c小鼠皮下注射免疫,每次0.2毫升,每周1次,共免疫5次。在採集血清前3天取0.2毫升刺激物小鼠尾靜脈注射加強免疫。用抗體親和層析柱純化蛇毒纖溶酶抗體。
用溴化氰活化二乙氨基葡聚糖凝膠,把得到的蛇毒激肽原酶抗體偶聯到多糖基質上,從而製成免疫親和層析柱。
- 實施例3 免疫抗體親和層析柱的製備
用高效液相色譜純化並經定性的蛇毒纖溶酶(活性組分2)400微克/毫升與等體積完全佐劑混合乳化作為刺激物,對7周齡的BALB/c小鼠皮下注射免疫,每次0.2毫升,每周1次,共免疫5次。在採集血清前前3天取0.2毫升刺激物小鼠尾靜脈注射加強免疫。用抗體親和層析柱純化蛇毒激肽原酶抗體。
用溴化氰活化羧甲基葡聚糖凝膠,把得到的蛇毒激肽原酶抗體偶聯到多糖基質上,從而製成免疫親和層析柱。
- 實施例4 高純度蛇毒纖溶酶原料藥製備
準確稱取蝮蛇蛇毒15克,用0.02摩爾/升pH7.8的Tris-HCl緩中液60毫升將其溶解提取,然後以4000轉/分鐘離心20分鐘取上清,沉澱用少量的緩衝液再次離心取上清,合併上清液裝透析袋對0.02摩爾/升pH7.8的Tris-HCl緩中液透析12小時待上樣。樣品透析完以後以6.0毫升/分鐘的流速上陰離子交換柱(DEAE-Sepharose),上樣完畢後用0.02摩爾/升pH7.8的Tris-HCL緩衝液洗脫未吸附的雜蛋白待透過峰下到基線時,分別用0.02摩爾/升Tris-HCL含0.05摩爾/升和0.115摩爾/升氯化鈉的緩衝液進行梯度洗脫收集活性峰(活性組分1)。將上述經離子交換純化的活性組分1用平衡液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl)透析,上抗體親和層析柱。用親和層析平衡液平衡,待流出液在蛋白檢測儀上繪出穩定的基線後,改用親和層析洗脫液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl,7%Arg)洗脫。收集洗脫峰,測定其酶的活性。
經活性檢測,收集到的組分具有很高的纖溶活性,取該組分適當稀釋,用高效液相色譜法檢測,獲得單組分圖譜,其保留時間為8.477,用SDS聚丙烯醯胺測定分子量為30800道爾頓。熱原、出血毒、神經毒、過敏檢查,均符合規定。
- 實施例5 高純度蛇毒纖溶酶原料藥製備
準確稱取蝮蛇蛇毒30克,用0.02摩爾/升pH7.8的Tris-HCl緩中液100毫升將其溶解提取,然後以4000轉/分鐘離心20分鐘取上清,沉澱用少量的緩衝液再次離心取上清,合併上清液裝透析袋對0.02摩爾/升pH7.8的Tris-HCl緩中液透析10小時待上樣。樣品透析完以後以8.0毫升/分鐘的流速上陰離子交換柱(DEAE-Sepharose),上樣完畢後用0.02摩爾/升pH7.8的Tris-HCL緩衝液洗脫未吸附的雜蛋白待透過峰下到基線時,分別用0.02摩爾/升Tris-HCL含0.05摩爾/升和0.110摩爾/升氯化鈉的緩衝液進行梯度洗脫收集活性峰(活性組分1)。將上述經離子交換純化的活性組分1用平衡液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl)透析,上抗體親和層析柱。用親和層析平衡液平衡,待流出液在蛋白檢測儀上繪出穩定的基線後,改用親和層析洗脫液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl,7%Arg)洗脫。收集洗脫峰,測定其酶的活性。
經活性檢測,收集到的組分具有很高的纖溶活性,取該組分適當稀釋,用高效液相色譜法檢測,獲得單組分圖譜,其保留時間為8.482,用SDS聚丙烯醯胺測定分子量為30500道爾頓。熱原、出血毒、神經毒、過敏檢查,均符合規定。
- 實施例6 高純度蛇毒激肽原酶原料藥製備
準確稱取蝮蛇蛇毒20克,用0.02摩爾/升pH7.8的Tris-HCl緩中液100毫升將其溶解提取,然後以4000轉/分鐘離心20分鐘取上清,沉澱用少量的緩衝液再次離心取上清,合併上清液裝透析袋對0.02摩爾/升pH7.8的Tris-HCl緩中液透析10小時待上樣。樣品透析完以後以8.0毫升/分鐘的流速上陰離子交換柱(DEAE-Sepharose),上樣完畢後用0.02摩爾/升pH7.8的Tris-HCL緩衝液洗脫未吸附的雜蛋白待透過峰下到基線時,分別用0.02摩爾/升Tris-HCL含0.05摩爾/升和0.115摩爾/升氯化鈉的緩衝液進行梯度洗脫收集活性峰(活性組分1)。將上述經離子交換純化的活性組分1用平衡液透析,上抗體親和層析柱。用親和層析平衡液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl)平衡,待流出液在蛋白檢測儀上繪出穩定的基線後,改用親和層析洗脫液(0.05MTris-HCL緩衝液,pH=7.8,含0.5MNacl,7%Arg)洗脫,收集洗脫峰,測定其酶的活性。
經活性檢測,收集到的組分具有很高的纖溶活性,取該組分適當稀釋,用高效液相色譜法檢測,獲得單組分圖譜,其保留時間為8.498,用SDS聚丙烯醯胺測定分子量為30150道爾頓。
熱原、出血毒、神經毒、過敏檢查,均符合規定。
二、高純度蛇毒纖溶酶的性能評定
1.比活力的測定
(1)試劑的配製
三羥甲基氨基甲烷緩衝液(pHpH7.8)取三羥甲基氨基甲烷2.42克,氯化鈉4.06克,加水400毫升溶解,用4摩爾/升鹽酸溶液調pH至7.8,加水至500毫升。
實驗緩衝液取三羥基甲基氨基甲烷緩衝液(pH7.8)、0.7%氯化鈣溶液和0.9%氯化鈉溶液以1∶2∶4體積混勻即得。
凝血酶溶液取凝血酶(中國藥品生物製品檢定所),加三羥基甲基氨基甲烷緩衝液(pH7.8)溶解並稀釋至每1毫升中含5單位的溶液。
纖維蛋白原溶液取纖維蛋白原(中國藥品生物製品檢定所),加三羥基甲基氨基甲烷緩衝液(pH7.8)溶解並定量稀釋至每1毫升中含可凝固蛋白約5毫克的溶液。
(2)供試品溶液的製備取供試品(依前述實施例4~6製備的高純度蛇毒纖溶酶,批號為040312、040315和040317,下同)適量,加三羥基甲基氨基甲烷緩衝液(pH7.8)溶解並定量稀釋至每1毫升中含15單位的溶液。
(3)測定法:取離心管,各精密加入實驗緩衝液0.2毫升,供試品溶液0.1毫升,置37℃水浴預熱2分鐘,加凝血酶溶液0.1毫升,纖維蛋白原溶液0.1毫升,立即振搖數秒,混勻,置37℃水浴準確反應30分鐘,置冰水浴中終止反應,離心(14000轉/分鐘)4分鐘,同法操作3次,小心將液體吸乾,在殘留物中精密加入0.2摩爾/升氫氧化鈉溶液3毫升,水浴加熱8分鐘,待纖維蛋白完全溶解,冷卻後,以0.2摩爾/升氫氧化鈉溶液為空白,照分光光度法(中國藥典2000年版二部附錄IVA),在280納米波長處測定吸收度A。同時以三羥甲基氨基甲烷緩衝液(pH7.8)0.1毫升代替供試品溶液同法操作測得As,作為空白對照。按下式計算供試品的活力單位:
每1毫克的供試品活力(U/毫克)=(As-A)×Ws×N/(As×0.1×30×W)
上式中:As-空白對照的吸收度;A-供試品溶液的吸收度;Ws-纖維蛋白原溶液0.1毫克中含可凝固蛋白的微克數;N-供試品稀釋倍數;0.1-供試品溶液體積,毫升;30-反應時間,分鐘;W-供試品取樣量,毫克。
纖溶酶活力單位定義:在上述條件下,1分鐘溶解1微克纖維蛋白(可凝固蛋白)為一個纖溶酶活力單位。
蛋白含量取供試品適量,加水製成每1毫升中約含0.15毫克蛋白的溶液,作為供試品溶液,精密量取供試品溶液1.0毫升,照“福林酚測定法”(見注)測定,計算每1毫克供試品中的蛋白量(毫克)。
註:福林酚測定法
試劑:鹼性銅試液取氫氧化鈉10克,硫酸鈉50克,加水400毫升使其溶解,作為甲液;取酒石酸鉀0.5克,加水50毫升使其溶解,另取硫酸銅0.25克加水30毫升使其溶解,將兩液混合作為乙液。
臨用前,合併甲、乙兩液,並加水至500毫升。
對照品溶液的製備:取牛血清白蛋白對照品,加水製成每1毫升中含0.3毫克的溶液。
供試品溶液的製備:取供試品適量,精密稱定,加水製成每1毫升中約含0.15毫克蛋白的溶液。
標準曲線的製備精密量取對照品溶液0.0毫升、0.2毫升、0.4毫升、0.6毫升、0.8毫升、1.0毫升,分別置具塞試管中,各加水至1.0毫升。再分別加鹼性銅試液1.0毫升,搖勻;各加入福林試液(中國藥典2000年版二部附錄XVB,取福林試液貯備液,按1∶15用水稀釋)4.0毫升,蓋塞,立即混勻。置55℃水浴中準確反應5分鐘,置冷水浴中10分鐘,照分光光度法(中國藥典2000年版二部附錄IVB)以0號管為空白,在650納米波長處測定吸光度。以對照品溶液濃度與其相對應的吸收度A對照進行直線回歸,求出回歸方程。
測定法精密量取供試品溶液1.0毫升,照標準曲線製備項下的方法,自“加入鹼性銅試液”起操作,測得其樣品的吸光度A樣品,從回歸方程計算蛋白的含量,並乘以稀釋倍數,即得。
比活,按下式計算: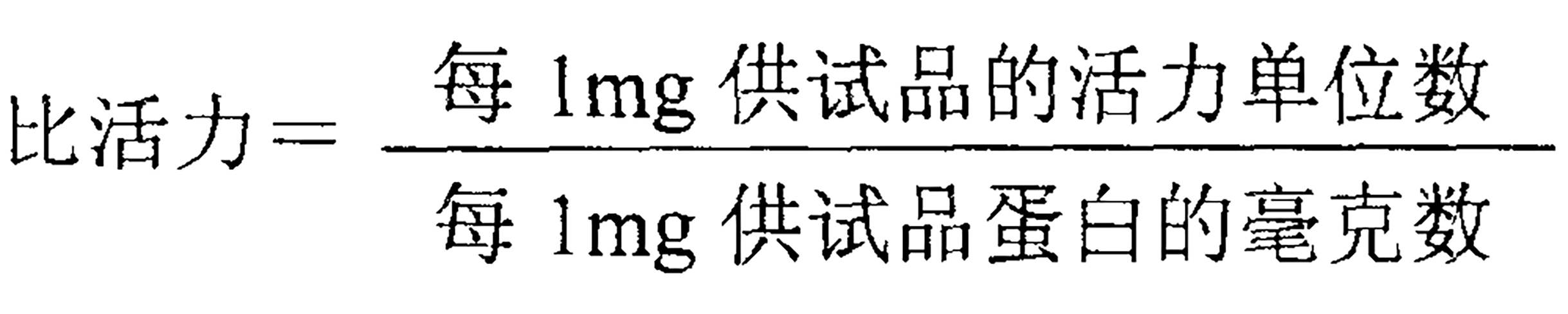
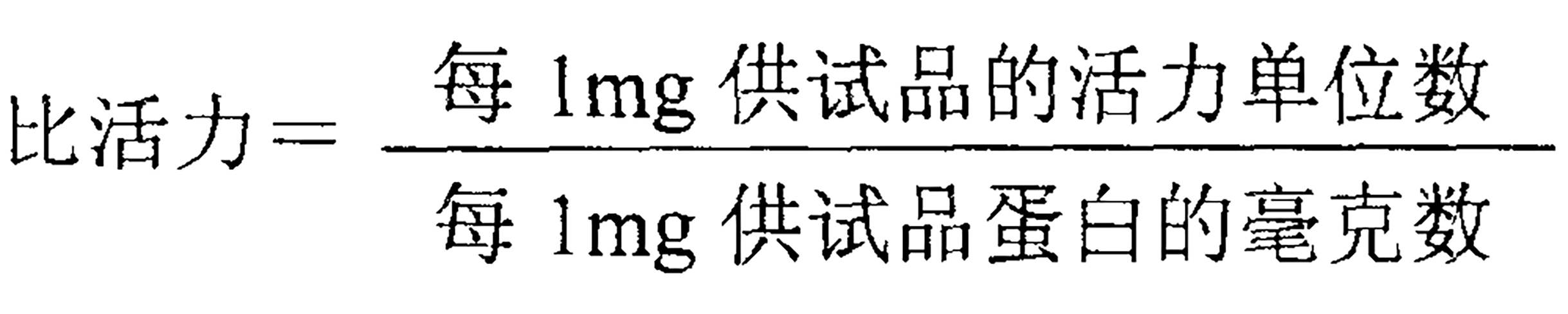
2.分子量測定
取該品,照電泳法(中國藥典2000年版二部附錄VF第五法SDS-聚丙烯醯胺凝膠電泳法)測定。
標準蛋白溶液的製備:取分子量測定用標準蛋白(分子量範圍1~10萬)適量,加供試品(依前述實施例4~6製備的高純度蛇毒纖溶酶,下同)緩衝液(取水4.8毫升,三羥甲基氨基甲烷緩衝液pH6.81.2毫升,甘油1.0毫升,10%十二烷基硫酸鈉2.0毫升,0.5%溴酚藍溶液0.5毫升,β-巰基乙醇0.5毫升,混勻)製成每1毫升中含1微克蛋白的溶液。臨用前置沸水浴中5分鐘,冷卻。
供試品溶液的製備:取供試品適量(按蛋白含量計算),加供試品緩衝液製成每1微升中含2微克蛋白的溶液,臨用前置沸水浴中5分鐘,冷卻。
測定法照上述電泳法試驗,採用垂直板電泳,每孔加5~10微升供試品溶液或標準蛋白溶液,考馬斯亮藍染色。以標準蛋白分子量的對數為縱坐標,以遷移率為橫坐標進行直線回歸,由回歸方程計算供試品的分子量。
測定結果:測定為一條帶,分子量應為31000±2000道爾頓,結果見圖4。
3.純度檢查
(1)如上在SDS-聚丙烯醯胺凝膠電泳上應顯示一條帶(詳見分子量測定)。
(2)照高效液相色譜法測定(中國藥典2000年版二部附錄VIH),供試品應為單一組分。
色譜條件與系統適用性試驗:
儀器型號:SHIMADZU(島津)、SPD-10Avp檢測器、SCL-10Avp控制器、LC-ATvp輸液泵、FCV-10ALvp溶劑切換器、PGU-14A脫氣機、Class-vp6.10色譜工作站。
TSK-2000(300×7.5毫米,5微米)凝膠色譜柱;流動相0.2摩爾/升磷酸鹽緩衝液(pH6.8);檢測波長280納米;流速1.0毫升/分鐘;溫度:25℃;理論板數按纖溶酶峰計算應不小於3000。
測定法:取供試品(依前述實施例4~6製備的高純度蛇毒纖溶酶)用流動相製成每1毫升含100單位的溶液,取20微升注入液相色譜儀,記錄色譜圖,按面積歸一化法計算,主峰面積應大於95%,保留時間應為8.3±0.5分鐘;主峰之前不得有高分子量雜質,三個批次樣品的HPLC測定結果見圖5~7。
4.熱原取供試品(依前述實施例4~6製備的高純度蛇毒纖溶酶,下同),用氯化鈉注射液製成每1毫升中含2單位的溶液,依法檢查(中國藥典2000年版二部附錄XID),按家免體重每1千克注射10毫升,應符合規定。
5.出血毒取供試品,加氯化鈉注射液製成每1毫升含4單位的溶液作為供試品溶液,取體重18~22克的小白鼠5隻,背部皮下注射供試品溶液0.1毫升,注射後24小時處死動物,剝皮觀察,小鼠背部不得有出血現象。
6.神經毒取供試品,加氯化鈉注射液製成每1毫升中含100單位的溶液,作為供試品溶液,取體重300~500克的鴿3隻,劑量按體重每1千克注射液注射供試品溶液0.5毫升,靜脈給藥,觀察24小時,動物不得出現抽搐、死亡,如3隻鴿中有一隻出現抽搐或死亡,應令取鴿5隻複試,均不得出現死亡。
7.過敏試驗取供試品適量,用氯化鈉注射液製成每1毫升中含2單位的供試品溶液作為致敏液與攻擊液。
取體重250-350克豚鼠6隻,間日腹腔注射供試品溶液0.5毫升,連續3次。然後將動物分成兩組,每組3隻,分別在第一次注射後第14日及第21曰靜脈注射供試品溶液1.0毫升進行攻擊。仔細觀察注射後15分鐘內豚鼠的反應,均不得出現過敏性反應。如有豎毛、呼吸困難、噴嚏、乾嘔或咳嗽3聲等現象中的兩種或兩種以上者;或囉音、抽搐、虛脫或死亡現象之一者,應判為陽性。三個批次樣品的檢定結果列表如下:
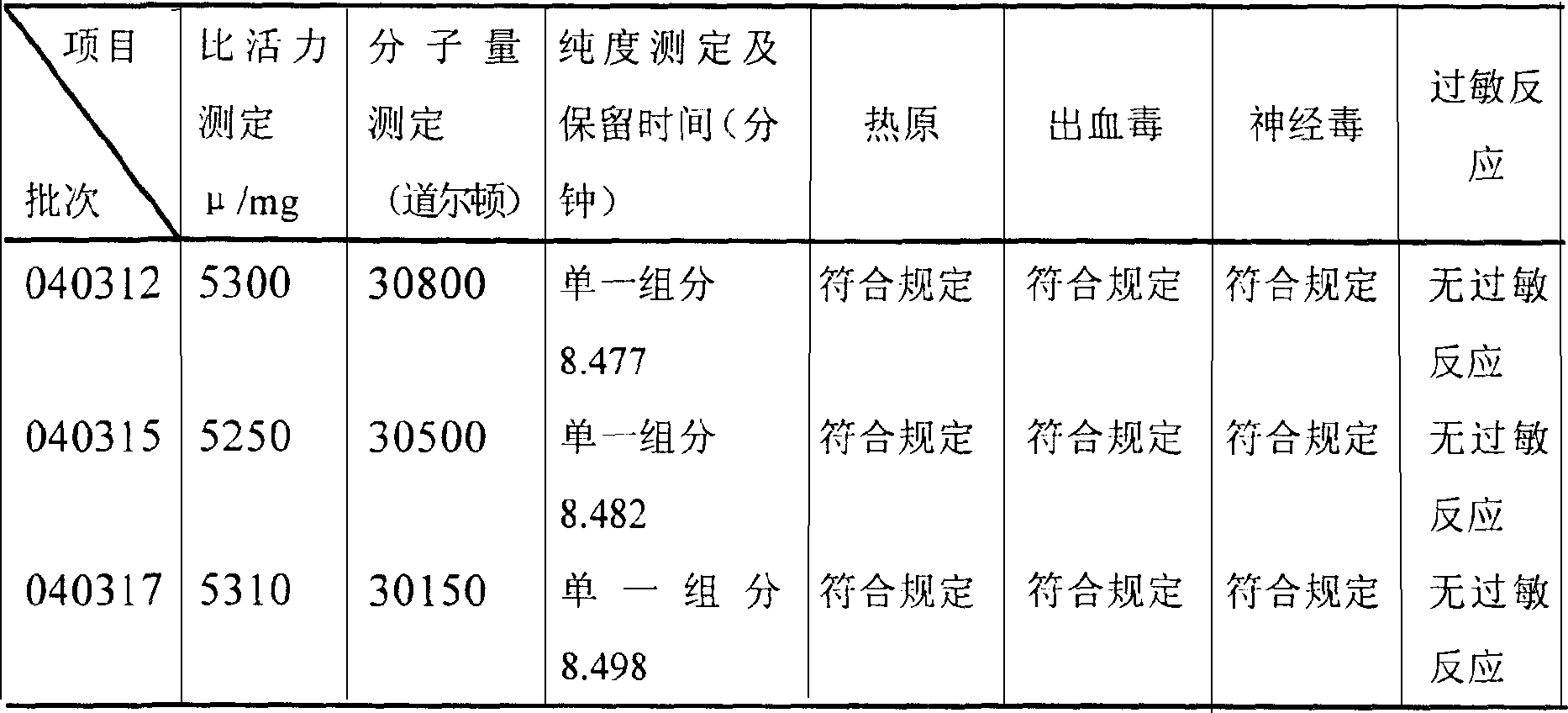
由檢定結果可以得出結論:運用免疫親和層析技術,從蛇毒中提取的纖溶酶純度高,獲得的產品比活高,達到每毫克蛋白5000單位以上,經HPLC檢查為單一組分,在SDS-聚丙烯醯胺凝膠電泳上顯示一條帶,分子量測定為29~33KD不含雜質,使用安全,能達到靜脈給藥的要求。
三、含高純度蛇毒纖溶酶的藥物製劑
- 實施例7 注射用纖溶酶與凍乾靜脈注射用纖溶酶製劑
首先,在局部百級潔淨區內按配製處方將纖溶酶原料藥(按照《高純度蛇毒纖溶酶的製備方法及其藥物製劑》前述實施例製備,並經各項檢測合格,下同)與白蛋白、氯化鈉、右旋糖酐等輔料準確稱量在配液容器內;加注射用水充分溶解或稀釋,使磷酸鹽的濃度為0.03摩爾/升,氯化鈉濃度為0.9%,右旋糖苷濃度為3%,攪拌混勻後,得到製劑中間體;除菌過濾,其中過濾前後應對除菌過濾系統進行完整性測試。然後,將過濾後的中間體按裝量裝入抗生素瓶,在分裝過程中應進行至少4次裝量檢查,保證每一隻瓶內裝入的藥量準確。最後,將裝入藥品的抗生素瓶碼在凍乾箱各層的隔板上,按照品種凍乾曲線進行速凍至零下20~30℃,維持8小時;然後抽真空,在真空狀態下緩慢升溫至35~40℃,保持一定時間,再降至室溫後取出。壓塞、軋蓋得成品。經過成品質量檢驗合格後,進行包裝,入庫。
實施例8 纖溶酶注射液與靜脈注射用纖溶酶製劑
首先,在局部百級潔淨區內按配製處方將蚓激酶原料藥與白蛋白、氯化鈉等輔料準確稱量在配液容器內;加注射用水充分溶解或稀釋,使磷酸鹽的濃度為0.03摩爾/升,氯化鈉濃度為0.9%,右旋糖苷濃度為3%,攪拌混勻後,得到製劑中間體;除菌過濾,其中過濾前後應對除菌過濾系統進行完整性測試。然後,將過濾後的中間體按裝量裝入抗生素瓶同時壓塞、軋蓋即得成品,在分裝過程中應進行至少4次裝量檢查,保證每一隻瓶內裝入的藥量準確。最後,經過成品質量檢驗合格後,進行包裝,入成品庫存放。
通過以上各實施例可見,《高純度蛇毒纖溶酶的製備方法及其藥物製劑》的方法從蛇毒原料中製備得到了高純度的蛇毒纖溶酶,以該高純度的蛇毒纖溶酶為原料,與各種藥學上可接受的載體以及賦形劑等輔料配合,可製備得到適於臨床套用的藥物製劑。
榮譽表彰
2016年12月7日,《高純度蛇毒纖溶酶的製備方法及其藥物製劑》獲得第十八屆中國專利優秀獎。

