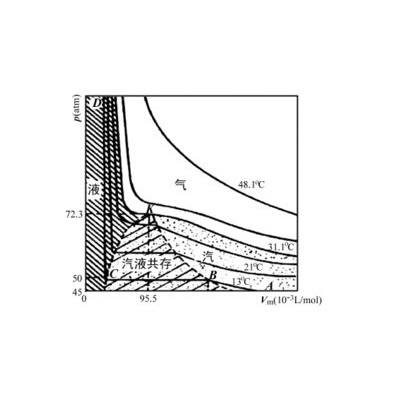
因為任何氣體在一點溫度和壓力下都可以液化,溫度越高,液化所需要的壓力也越高,但是當溫度超過某一數值時,即使在增加多大的壓力也不能液化,這個溫度叫駐點溫度。
基本介紹
- 中文名:駐點溫度
- 外文名:stagnation temperature
- 別名:臨界溫度
定義,定義解釋,說明,狀態的認識過程,超臨界流體,
定義
1869年Andrews首先發現臨界現象。任何一種物質都存在三種相態----氣相、液相、固相。三相呈平衡態共存的點叫三相點。液、氣兩相呈平衡狀態的點叫臨界點。在臨界點時的溫度和壓力稱為臨界溫度和臨界壓力。不同的物質其臨界點所要求的壓力和溫度各不相同。
使物質由氣態變為液態的最高溫度叫駐點溫度,也叫做臨界溫度。每種物質都有一個特定的溫度,在這個溫度以上,無論怎樣增大壓強,氣態物質都不會液化,這個溫度就是臨界溫度。也稱為臨界溫度。既可以表示物質處於臨界狀態時的溫度,也可以表示物質以液態形式出現的最高溫度。
定義解釋
1.物質處於臨界狀態時的溫度。
2.物質以液態形式出現的最高溫度。
3.高於臨界溫度,無論加多大壓力都不能使氣體液化。在臨界溫度時,使氣體液化所必須的最低壓力叫臨界壓力。
4.臨界溫度越低,越難液化。
說明
1)每種物質都有一個特定的溫度,在這個溫度以上,無論怎樣增大壓強,氣態物質不會液化,這個溫度就是臨界溫度。因此要使物質液化,首先要設法達到它自身的臨界溫度。有些物質如氨、二氧化碳等,它們的臨界溫度高於或接近室溫,對這樣的物質在常溫下很容易壓縮成液體。有些物質如氧、氮、氫、氦等的臨界溫度很低,其中氦氣的臨界溫度為-268℃。要使這些氣體液化,必須相應的要有一定的低溫技術,以使能達到它們各自的臨界溫度,然後再用增大壓強的方法使它液化。
2)通常把在臨界溫度以上的氣態物質叫做氣體,把在臨界溫度以下的氣態物質叫做汽。 臨界溫度物質處於臨界狀態時的溫度,稱為“臨界溫度”。降溫加壓,是使氣體液化的條件。但只加壓,不一定能使氣體液化,應視當時氣體是否在臨界溫度以下。如果氣體溫度超過臨界溫度,無論怎樣增大壓強,氣態物質也不會液化。例如,水蒸汽的臨界溫度為374℃,遠比常溫度要高,因此,平常水蒸汽極易冷卻成水。其他如乙醚、氨、二氧化碳等,它們的臨界溫度略高於或接近室溫,這樣的物質在常溫下很容易被壓縮成液體。但也有一些臨界溫度很低的物質,如氧、空氣、氫、氦等都是極不容易液化的氣體。其中氦的臨界溫度為-268℃。要使這些氣體液化。必須具備一定的低溫技術和設備,使它們達到它們各自的臨界溫度以下,而後再用增大壓強的方法使其液化。
狀態的認識過程
通常我們所見到的物質常以三種形態存在,即固體、液體和氣體。形態是物質的一種屬性,不同物質的形態有所不同,如鐵是固體,水是液體,空氣是氣體等。一種物質所具有的形態與其所存在的客觀條件有關,並非永恆不變。
例如,在一般情況下二氧化碳是氣體,但在一定的低溫和一定壓力下也可以是液體或固體(俗稱乾冰)。其它物質的形態也同樣隨著外界條件的變化而改變。氣體變成液體的過程叫做氣體的液化。對氣體能否變成液體的問題是有個認識過程的。早在19世紀以前,曾認為氣體本質上就是氣體,不能使之改變。只是在19世紀20年代,人們才成功地用加大壓力的辦法做氨氣、氯氣、二氧化碳及其它一些氣體變成液體。但是還有許多其它氣體(如組成空氣的主要成分——氮氣和氧氣),雖然作了很大努力,也不能使之液化。因此,人們曾錯誤地認為當時還不能液化的這些氣體是“永久氣體”,這種形上學的觀點,阻礙了人們進一步研究如何使空氣液化的工作。隨著科學的不斷發展,人們逐漸認識到:組成物質的分子間都存在相互吸引和相互排斥的兩種作用力,當分子間相互排斥力>分子間相互吸引力時,物質的氣體;當分子間的相互吸引力>分子間的相互排斥力或至少等於排斥力的時候,氣體才有可能轉變為液體。分子間的相互吸引作用,實際上可以認為不依賴於溫度;相反,由分子的相互撞擊而引起互相排斥作用則強烈地依賴於溫度,所以只有當氣體的溫度降低到一定程度時,才有可能使分子間的吸引作用≥分子間的排斥作用。即才有可能使氣體變為液體。
這種使分子間的吸引作用等於分子間的排斥作用時,所許可存在的最高溫度叫做該氣體的臨界溫度。當高於臨界溫度時無論外加多大的壓力,都不能使氣體液化。在臨界溫度下使氣體液化所需的最低壓力,叫做臨界壓力。
不同的氣體,它們的臨界溫度和臨界壓力也不相同,臨界溫度較高的氣體,如氨、氯氣、二氧化碳,二氧化硫和乙炔等氣體,在常溫下(低於它們的臨界溫度)加壓就能液化,臨界溫度較低的氣體,如氧氣、一氧化碳等,需經壓縮並冷卻到一定溫度以下才能液化;臨界溫度很低的氣體如氫和氦等,需經壓縮並冷卻到接近絕對零度(-273.16℃)的低溫才能液化。氦的臨界溫度最低,它是最後一個轉變成液體的氣體。
隨著生產的發展,液化氣體有著廣泛的套用。將氣體變成液體後體積大為減小,便於貯存運輸和使用。例如我們常見的液氨、液氯和液化石油氣(主要成分是丙烷、丁烷、丙烯、丁烯)等。氣體的液化也常用於混合氣體的分離,如空氣液化後,可用來分離出氮氣、氧氣及其它稀有氣體等,此外,氣體的液化對現代科學技術的發展也具有重要的意義,例如液氧可用於製造液氧炸藥和高能燃料的助燃劑。液氫可用作高能燃料;液氦可用來獲得絕對零度(-273.16℃)的低溫等。
超臨界流體
SCF,是指在臨界溫度和臨界壓力以上的流體。高於臨界溫度和臨界壓力而接近臨界點的狀態稱為超臨界狀態。處於超臨界狀態時,氣液兩相性質非常接近,以至於無法分辨,故稱之為SCF。
自從1869年Andrews首先發現臨界現象以來,各種研究工作陸續開展起來,其中包括1879年Hannay和Hogarth測量了固體在超臨界流體中的溶解度,1937年Michels等人準確地測量了CO2近臨界點的狀態等等。在純物質相圖上,一般流體的氣-液平衡線有一個終點——臨界點,此處對應的溫度和壓力即是臨界溫度(Tc)和臨界壓力(Pc)。當流體的溫度和壓力處於Tc和Pc之上時,那么流體就處於超臨界狀態(supercritical狀態,簡稱SC狀態)。超臨界流體的許多物理化學性質介於氣體和液體之間,並具有兩者的優點,如具有與液體相近的溶解能力和傳熱係數,具有與氣體相近的黏度係數和擴散係數。同時它也具有區別於氣態和液態的明顯特點:
(1)可以得到處於氣態和液態之間的任一密度;
(2)在臨界點附近,壓力的微小變化可導緻密度的巨大變化。
由於黏度、介電常數、擴散係數和溶解能力都與密度有關,因此可以方便地通過調節壓力來控制超臨界流體的物理化學性質。與常用的有機溶劑相比,超臨界流體特別是SCCO2、SCH2O還是一種環境友好的溶劑。正是這些優點,使得超臨界流體具有廣泛的套用潛力,超臨界流體萃取分離技術已得到了廣泛的醫藥套用。