雙膜理論(two-film theory),為氣液界面傳質過程的經典理論。由惠特曼(W.G. Whitman)和劉易斯(L.K. Lewis)於20世紀20年代提出,模型經多次改進,已成功用於環境中化合物在大氣-水界面間的傳質過程,較好地解釋了液體吸收劑對氣體吸收質的吸收過程。
基本介紹
- 中文名:雙膜理論
- 外文名:Two-film theory
- 實質:氣液界面傳質過程的經典理論
- 時間:1923年
- 提出者:惠特曼和劉易斯
理論要點
理論方程
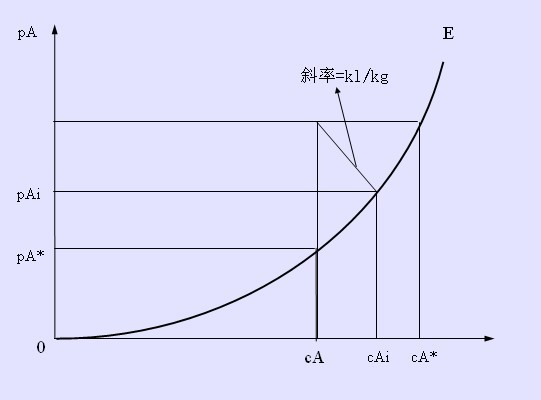 相平衡關係曲線
相平衡關係曲線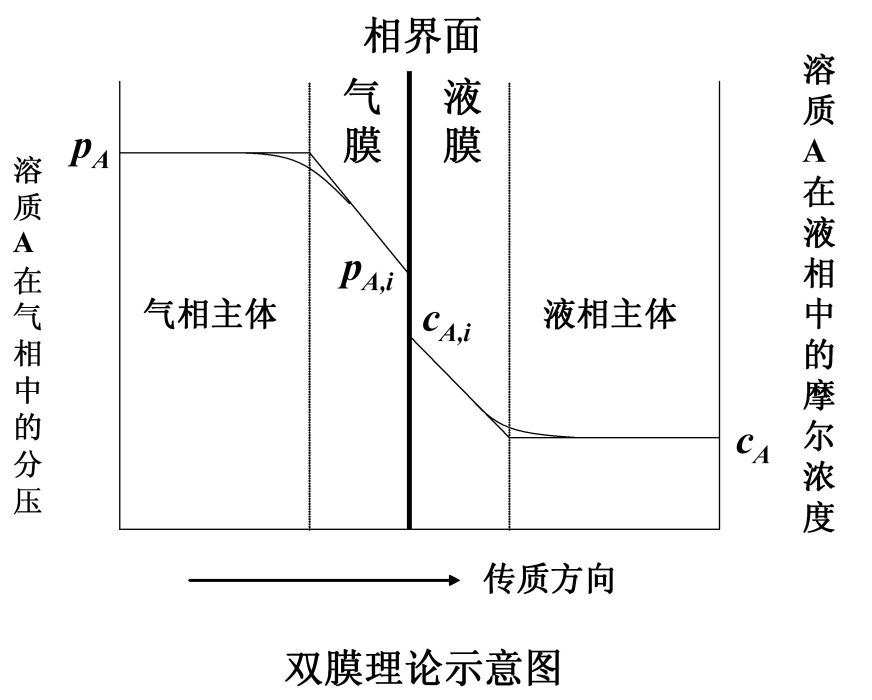
雙膜理論(two-film theory),為氣液界面傳質過程的經典理論。由惠特曼(W.G. Whitman)和劉易斯(L.K. Lewis)於20世紀20年代提出,模型經多次改進,已成功用於環境中化合物在大氣-水界面間的傳質過程,較好地解釋了液體吸收劑對氣體吸收質的吸收過程。

 相平衡關係曲線
相平衡關係曲線雙膜理論(two-film theory),為氣液界面傳質過程的經典理論。由惠特曼(W.G. Whitman)和劉易斯(L.K. Lewis)於20世紀20年代提出,模型經多次改進,已成功用於環境...
理論級理論級概念 編輯 已知進行過程數學描述的依據是:①物料衡算方程;②相平衡關係;③過程速率方程。在填料吸收塔中,以雙膜理論為依據,推出了吸收速率方程。進而...
停滯膜模型為傳質理論奠定了初步基礎。但另一方面,該模型對傳質機理的解釋過於簡單化,因此對於許多傳質設備,特別是不存在固定相界面的傳質設備,雙膜模型並不能反映出...
氣膜控制是傳質阻力主要集中於氣相的吸收過程。根據雙膜理論,吸收過程的傳質阻力係數由氣膜吸收阻力和液膜吸收阻力兩者所組成。當吸收質為較大的氣體時,溶解度係數...
(1)雙膜理論:1923年由美國麻省理工學院教授W.K.劉易斯和W.惠特曼提出的一種描述氣液兩相相際傳質的模型。其基本論點為:①氣液兩相接觸時存在一個穩定的相界面,...
因而引出了“表面年齡”的概念,算得的結果與雙膜理論的結果相差很小。界面傳遞擴散邊界層 緊靠兩相界面、濃度起激烈變化的流體薄層稱為擴散邊界層或傳質邊界層。...
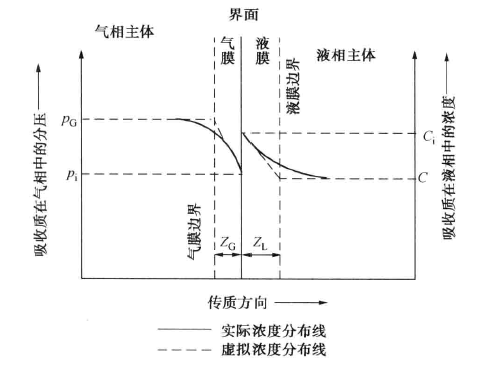
吸收過程可以用雙膜理論解釋,如圖所示,其主要論點如下。(1)在傳質過程中,氣液兩相間有一個穩定的相界面。相界面兩邊分別是氣體薄膜和液體薄膜。在任何流動狀態下...
根據雙膜理論,吸收過程的傳質阻力系由氣膜吸收阻力和液膜吸收阻力兩者所組成,即 式中:KG為根據氣相總推動力的傳質吸收;kG和kL分別為氣相和液相傳質分係數;H為...
根據雙膜理論,對於氣液相傳質體系,採用兩相主體的濃度的某種差值表示總推動力而寫出傳質速率方程,其中的係數即為總傳質係數。它的倒數為總阻力,為氣膜和液膜傳質...
根據雙膜理論,對於氣液相傳質體系,採用兩相主體的濃度的某種差值表示總推動力而寫出傳質速率方程,其中的係數即為總傳質係數。它的倒數為總阻力,為氣膜和液膜傳質...
液膜傳質係數是根據雙膜理論,對於氣液相傳質體系,在穩定條件下,單獨根據液膜的推動力和阻力計算傳質速率時所用的係數。...
施密特數理論闡明物質通過兩相界面傳遞的機理的理論。主要有下列幾種:①雙膜理論構想在兩相(例如氣-液)界面兩側分別存在著一層氣膜和液膜,膜內沒有法向流動,只有...
當接觸時間趨於無窮時,彼此停留時間都將一樣,且達到建立穩定的分子擴散所需的時間也一樣,此時表面更新理論又和雙膜理論一致了。所以從某種意義上來說,滲透論與雙...
第7 章 傳質理論及多組分系統的傳質 2037.1 早期經典的傳質理論 2037.1.1 雙膜理論 2047.1.2 滲透理論 2057.1.3 表面更新理論 2057.1.4 經典傳質...
氣相控制gas phase control又稱氣膜控制。在氣液網相傳質中。氣膜阻力很大,液膜阻力可忽略不計的過程。根據雙膜理論,傳質阻力有如一下關係:_1' } r.一1HkL...
六、兩相間傳質的雙膜理論219七、總傳質速率方程221八、傳質速率方程式的各種表示形式223第四節吸收塔的計算225一、物料衡算與操作線方程225...
二、雙膜理論135第四節傳質速率方程136一、氣相傳質速率方程137二、液相傳質速率方程137三、總傳質速率方程137四、總傳質係數與膜傳質係數的關係138第五節填料吸收...
13.3 雙膜理論與相間穩態傳質本章小結習題第14章 動量、熱量、質量的傳輸類比14.1 三傳的基本定律和基本方程14.2 三傳的類比14.3 類似關係的特徵數本章小結...
並與W.惠特曼創雙膜理論。他在皮革、橡膠製造、蒸餾、過濾、石油裂解、催化劑等方面貢獻較大。在兩次世界大戰期間,擔任有關防禦毒氣戰爭、發展核武器等工作的政府...
如果液膜中氧的濃度低於水中氧的飽和濃度,空氣中的氧繼續向內擴散透過液膜進入水體,因而液膜和氣膜將成為氧傳遞的障礙,這就是雙膜理論。顯然,克服液膜障礙最...
四、傳質的基本方式276五、吸收機理——雙膜理論277第三節吸收速率方程式278一、吸收速率方程式278二、氣體溶解度對吸收係數的影響280第四節吸收過程的計算282...
