環己烯與溴的加成中,與Br2加成首先得環正離子,Br從離去基團背後進攻,得反式加成產物即具有雙直鍵的二溴化物,一旦形成,很快轉變為構象異構體,生成具有雙平鍵的二溴化物。
基本介紹
- 中文名:雙直鍵加成
- 反應:環己烯與溴的加成
- 生成:具有雙直鍵的二溴化物
- 轉變:具有雙平鍵的二溴化物
- 屬於:協同反應
溴與環己烯反應,環加成,
溴與環己烯反應
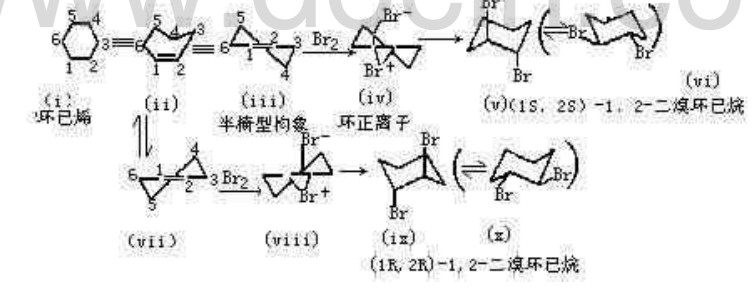
在環己烯中,雙鍵及其兩個鄰接的碳原子C-6,C-1,C-2,C-3在一個平面上,因此C-4,C-5在環平面的上面和下面,如ii所示,在加成反應中為了易於表達常把它寫成半椅型。(iii)與Br2加成首先得(iv),Br從離去基團背後進攻C1得反式加成產物,即具有雙直鍵的二溴化物。
 環己烯與溴
環己烯與溴Br-C-C-Br四個原子排列是反式共平面,Br-與(iv)中的C-1結合,是使構象最小的改變,即C-3,C-4,C-5,C-6的碳架改變最小,維持原來的椅型構象;如與C-2結合,要轉變成另一椅型構象如(ix),這時需要能量較大。加成的最初產物是雙直鍵的一溴化物(vi)生成後,很快地發生椅型-椅型的構象體互相轉換,形成雙平鍵的—溴化物(vi),(v)與(vi)達成平衡。一般化合物雙平鍵構象穩定,占優勢,但(v)與(vi)兩種構象幾乎相等,因為雙直鍵的一溴化物有1,3-雙直鍵的相互作用,但雙平鍵的一溴化物中Br-C-C-Br為鄰交叉型,有偶極-偶極的排斥作用,以上兩種作用力能量幾乎相等。
環加成
屬於協同反應的範疇,常見的有狄爾斯-阿德爾反應。
雙烯合成反應經過一個六元環過渡態,不存在中間步驟。
是指舊鍵的斷裂和新鍵的生成同時發生於同一過渡態的一步反應過程。
周環反應就是一類重要的協同反應。