基本信息
定律簡介
道爾頓分壓定律(也稱
道爾頓定律)描述的是
理想氣體的特性。這一經驗定律是在
1801年由
約翰·道爾頓所觀察得到的。在任何容器內的氣體混合物中,如果各組分之間不發生
化學反應,則每一種氣體都均勻地分布在整個容器內,它所產生的壓強和它單獨占有整個容器時所產生的壓強相同。也就是說,一定量的氣體在一定容積的容器中的
壓強僅與溫度有關。例如,零攝氏度時,1mol 氧氣在 22.4L 體積內的壓強是 101.3kPa 。如果向容器內加入 1mol 氮氣並保持容器體積不變,則氧氣的壓強還是 101.3kPa,但容器內的總壓強增大一倍。可見, 1mol 氮氣在這種狀態下產生的壓強也是 101.3kPa 。道爾頓分壓定律從原則上講只適用於
理想氣體混合物,不過對於
低壓下真實氣體混合物也可以近似適用。
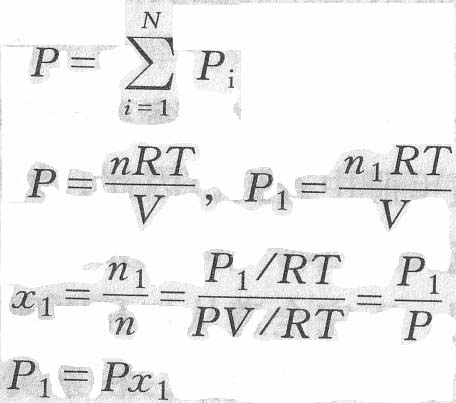
道爾頓(Dalton)總結了這些實驗事實,得出下列結論:某一氣體在氣體
混合物中產生的分壓等於在相同溫度下它單獨占有整個容器時所產生的壓力;而氣體混合物的總壓強等於其中各
氣體分壓之和,這就是
氣體分壓定律(law of partial pressure)。
即
理想氣體混合物中某一組分B的分壓等於該組分單獨存在於
混合氣體的溫度T及總體積V的條件下所具有的壓力。而
混合氣體的總壓即等於各組分單獨存在於混合氣體溫度、體積條件下產生壓力的總和。這即為
道爾頓分壓定律。
道爾頓定律只適用於理想氣體混合物,實際氣體並不嚴格遵從道爾頓分壓定律,在高壓情況下尤其如此。當壓力很高時,
分子所占的體積和分子之間的空隙具有可比性;同時,更短的分子間距離使得
分子間作用力增強,從而會改變各組分的分壓力。這兩點在
道爾頓定律中並沒有體現。
人物歷史
道爾頓於1766年出生在英格蘭北方鷹田莊。他只是在11歲以前受過正規教育,幾乎完全是靠自學掌握了科學知識。他才智早熟,12歲就當上了教師。15歲遷往肯德爾城,26歲又遷到曼徹斯特,在那兒一直居住到1844年去世。他終生未娶。
道爾頓在1787年時對氣象學發生了興趣,六年後發表了一本有關氣象學的書。對空氣和大氣的研究又使他對一般氣體的特徵發生了興趣。通過一系列的實驗,他發現了有關氣體特性的兩個重要定律。第一個定律是
道爾頓在
1801年提出來的,該定律認為一種氣體所占的體積與其溫度成正比(一般稱為查爾斯定律,是根據法國科學家查爾斯的名字命名的。他比
道爾頓早幾年發現了這個定律,但未能把其成果發表出來)。第二個定律是
1801年提出來的,叫做
道爾頓氣體分壓定律。
1804年
道爾頓就已系統地提出了他的
原子學說,並且編制了一張原子量表。但是他的主要著作《
化學哲學的新體系》直到1808年才問世,那是他的成功之作。他在晚年獲得了許多榮譽。
附帶一提的是
道爾頓患有色盲症。這種病的症狀引起了他的好奇心。他開始研究這個課題,最終發表了一篇關於色盲的論文──曾經問世的第一篇有關色盲的論文。
成就與學說
人物成就
英國科學家約翰·
道爾頓在19世紀初把原子假說引入了科學主流。他所提供的關鍵的學說,使
化學領域自那時以來有了巨大的進展。
相關學說
確切地說,並不是
道爾頓首先提出所有的物質都是由極其微小的、不可毀壞的粒子──人稱
原子組成的。這個概念是由古希臘哲學家德漠克利特提出來的,甚至在他以前可能就有人提出過。另一位希臘哲學家
伊壁鳩魯(公元前342—270年?)採用了這一假說。羅馬作家留克利希阿斯(公元前99?-55年)在他的著名詩歌《論事物的本質》中對這一假說做了生動形象的介紹。
德謨克利特的學說未被亞里士多德接受,在中世紀受到了忽視,對現代科學沒有什麼影響。但是17世紀有幾個包括艾薩克·牛頓在內的主要科學家支持過類似的學說。不過早期的
原子學說都沒有定量表達,也沒有用於科學研究,最根本的是誰也沒有看到哲學的假想和
化學的嚴酷事實之間存在的聯繫。
這就是
道爾頓的貢獻所在。他提出了一個明了的定量學說,可以用來解釋
化學實驗,並經受住了實驗室的精確檢驗。
雖然
道爾頓的術語與我們現在使用的稍有不同,但是卻清楚地表述了
原子、
分子、元素等概念。他明確指出;雖然世界上
原子的總數目相當之大,但是不同原子種類的數目卻是非常之小(他的原著中列出20種元素即20種原子,今天所知道的元素有一百多種)。
雖然不同種類的
原子有不同的重量,但是
道爾頓認為任何兩個同類原子的所有性質包括重量都相同。
道爾頓在他的書中列出了一張各種不同類原子的相對重量表──有關這方面的第一張表,是定量
原子學說的一個重要特徵。
道爾頓還明確地指出,任何相同化合物的兩個
分子都是由相同
原子組成的(例如,每個氧化亞氮都是由兩個氮原子和一個
氧原子組成的)。由此可推出一種已知的化合物──不管是由什麼方法配製或在哪裡發現的──總含有相同的元素,而且這些元素之間的重量比完全一樣。這就是約瑟夫·路易斯·普勞特幾年前在實驗中發現的“
定比定律”。
道爾頓的學說非常具有說服力,不到二十年的時間就為大多數科學家所採納。而且
化學家按照書中所提出的方案行事:準確地確定出相對原子重量和每種
分子的
原子數;定量分析化合物。當然這個方案已取得徹底的成功。
原子假說的重要性是不易被誇大的。它是我們認識
化學的主要學說,而且在很大程度上是現代物理學的一個不可缺少的序幕。只是因為在
道爾頓以前就有人經常討論
原子論,所以他在此冊中的名次並不很高。