軟酸(soft-acid)即路易斯酸,具有體積大、正電荷少、易極化、易失去電子、易形成共價性較強的鍵的物質。軟酸易與軟鹼生成穩定的絡合物;軟酸不易與硬鹼生成絡合物,或生成的絡合物不穩定,常見的Cu+、Ag、Hg、Cd等,均屬軟酸。軟硬酸鹼的溉念,是對路易斯酸鹼概念的發展。
基本介紹
- 中文名:軟酸
- 外文名:soft-acid
- 來源:路易斯酸鹼概念
軟酸為中心離子的配位催化,軟酸配合物的性質,雙鍵移動及異構化,硬酸和軟酸;硬鹼和軟鹼,判斷軟酸與硬酸的規則,
軟酸為中心離子的配位催化
低價金屬離子配合物和反饋鍵起主導作用的配位絡合催化劑,包括第一周期低價過渡金屬與CO、烯烴的配合物,以及第二、三周期過渡金屬的烯烴配合物。
烯烴的氫醛化反應(羰基合成,OXO-synthesis),雙鍵異構化和N2分子的配位活化都是具有重要意義的催化反應。
軟酸配合物的性質
Pauling提出的化合物電中性原則是普遍法則,配合物當然不能例外,中心離子的正電荷須由配體的負電荷來中和。另一個規則就是前述的有效原子序數規則(EAN),這個規則對典型元素是成立的,但對過渡元素就缺乏普遍適用性了。前面已經介紹過,有些過渡金屬配合物很穩定,但不符合EAN規則,這是因為過渡金屬的d、f軌道在形成配位鍵時,能發揮特有的穩定性。
例如降低中心離子的原子價,這意味著從外界加入了電子,電子數增加了,為了維持配合物的穩定性,根據電中性原則須設法(例如氧化反應)把這部分電子移出。如果仍要維持中心離子的低價狀態,而又使配合物有一定的穩定性,就只好把這部分電子通過。給予,或暫存到配體的低能空軌道的辦法,在配合物分子內部解決。
第二、三周期過渡金屬的電負性與碳原子相近,4d、5d軌道又與配體分子軌道顯著重疊,低價態自不待言,正常價態(+2,+3,+4)也能形成M--C的σ鍵,能形成CO、烯烴配合物,它們比第一周期過渡金屬配合物更穩定。
第一周期低價過渡金屬離子和第二、三周期過渡金屬離子,能與含碳化合物形成π鍵和σ鍵配位,這種配位可用於調控有機化合物的某些反應。例如:
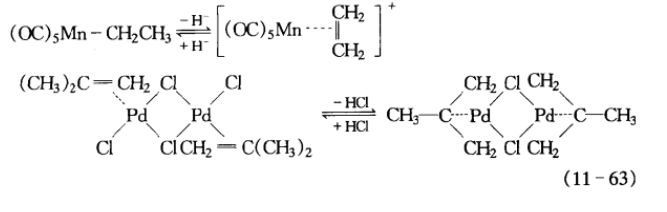
離子反應例證
雙鍵移動及異構化
固體酸可由強質子加成一脫離來催化烯烴的雙鍵異構化。本節介紹的催化過程是由第一周期低價過渡金屬丌配合物(如羰基、羥羰基配合物),以及第二、三周期過渡金屬化合物,特別是鹵化物來實現的。
Cramer等報導Rh、Pt、Pd、Nii和Fe化合物,在能提供氫源的共催化劑(酸)存在下,可使丁烯異構化的催化反應在氘化溶劑中進行。1一丁烯在CH3OD中異構化生成d-1一丁烯,不生成d一2一丁烯。圖1是丁烯異構化的H一D交換歷程。
圖1中A是H—D交換循環,B是丁烯異構化循環。它們的相對反應速度取決於催化劑和烯烴。Pt,H一D交換優先;Rh、DFe(CO)4、LiPdCl4和Ni(P(OEt)3)4則異構化優先。這些催化劑都有順反異構化功能。
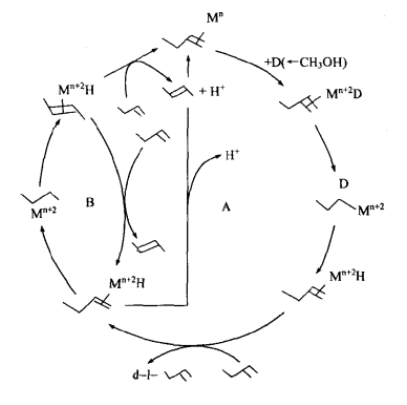
圖1 丁烯異構化與H一D交換流程圖
有雙鍵的環辛二烯,用Fe(CO)5異構化是1,5-COD→1,3-COD反應,對形成共軛雙鍵有利;用RhCl3催化則情況相反,是1,3-COD→1,5-COD。從熱力學角度看,有共軛雙鍵的1,3-COD穩定,故Fe(CO)5的催化反應是正常的;Rh的情況是因為1,5-COD與Rh能形成穩定的螯合型π配合物,所以使反應轉向更穩定的方向。與1,5-COD不形成穩定配合物的IrHCl(PPhEt2)和RhCl3(PPhEt2)3都是1,5-COD→1,3-COD的優秀催化劑。

正在載入展開全文
正在載入載入更多
查看更多
打開百度App閱讀全文
