基本介紹
- 中文名:肌原纖維蛋白
- 外文名:myofibrillar protein
- 含量:總蛋白含量的50%~60%
- 分類:肌球蛋白、肌球蛋白、肌動球蛋白
- 特性:凝膠作用
- 用途:增加肉製品風味
定義,分類,肌球蛋白,肌動蛋白,肌動球蛋白,研究現狀,國內研究現狀,國外研究現狀,
定義
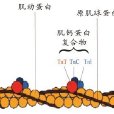
肌原纖維蛋白是組成肌肉中肌原纖維的蛋白質,主要包括原肌球蛋白、肌球蛋白、肌原蛋白、肌動球蛋白等幾類。其中肌球蛋白占蛋白質總量的50%~55%,肌動蛋白占蛋白質總量的20%~25%,還有原肌球蛋白、肌原蛋白和少量功能不明的調節性結構蛋白質。

肌原纖維蛋白空間結構,蛋白的水合性質和功能的關係對肌肉品質有重要的影響,蛋白在加熱、添加 NaCl 和多糖等因素會直接或者間接地影響到肌原纖維蛋白的性質,使肌原纖維蛋白分子展開,進行有序或者無序的聚合,形成凝膠對肉製品造成影響,肌原纖維蛋白的加熱速度對肉製品也有一定的影響,對肌原纖維蛋白快速加熱,使蛋白變性,疏水性基團暴露在蛋白外部,對肉的乳化性和乳化穩定性造成影響。
分類
肌肉中最基本的組織是肌纖維,肌纖維的主要成分為肌原纖維,肌原纖維的橫切面可見大小不同的漏膠乃點有序排列捉狼道漿,這些點就是肌原絲,肌原絲可分為粗肌原絲(簡稱粗絲)和細肌原絲(簡稱細絲)。
肌球蛋白
肌球蛋白是肌肉中含量最高的蛋白,約占肌肉總蛋白質的三分之一,占肌原纖維蛋白的50%~55%,肌球蛋白笑兆朵是肌肉粗絲的主要成分,它有兩條很長的的肽鏈相互盤旋構成的。在構成粗絲時,肌球蛋白的尾部相互重疊,而頭部伸出在外,並做有規則的排列。肌球蛋白不溶於水或者微溶於水,屬於球蛋白性質,在中性鹽溶液中可溶解,等電點為 5.4,在 50~55℃發生凝固,易形成黏性凝膠。肌球蛋白的頭部有 ATP 酶活性,可以分解 ATP,並且與肌動蛋白結合形成肌動球蛋白。
肌動蛋白
肌動蛋白占肌原纖維蛋白的 20%,是構成細絲的主要成分。即從蛋白只有一天多肽鏈構成,肌動蛋白單獨存在時,為一球形的蛋白質分子結構,肌動蛋白的性質屬於白蛋白類,它還能溶於水及稀的鹽溶液中,等電點 4.7。肌動蛋白的作用是與肌球蛋白的橫突形成交聯,共同參與肌肉的收縮過程。
肌動球蛋白
肌動球蛋白是肌動蛋白與肌球蛋白的複合物,肌動球蛋白的黏度很高,具有明顯的流動雙折射現象,由於其聚合度不同,因而相對分子量不定。肌動蛋白與肌球蛋白結合的比例在1:(2.5~4)。肌動蛋白具有 ATP 酶的活性。高濃度的肌動球蛋白易形成凝膠。在高濃度的 KCl 溶液中,添加焦磷酸鹽肌動球蛋白分解為肌動蛋白和肌球蛋白。
研究現狀
國內研究現狀
在肌原纖維蛋白方面的研究主要有(夏秀芳 et al., 2009)闡述了蛋白質凝膠形成的機理,重點論述了肌原纖維蛋白形成良好凝膠的影響因素,為生產高質量的肉製品提供理論依據。PSE 肉的肌原纖維項狼危蛋白質的溶解度比正常肉(red, firmandnon-exudative; RFN)低、凝膠性質比 RFN 差,探討了磷酸鹽對 PSE 豬肉凝膠特性的影響。磷酸鹽對 PSE 和 RFN提取肌原纖維蛋白的溶解度、蛋白質聚集性和凝膠強放料歡度均有顯著的影響,磷酸鹽可改善體系環境,改善 PSE 蛋白質溶膠及凝膠的功能特性。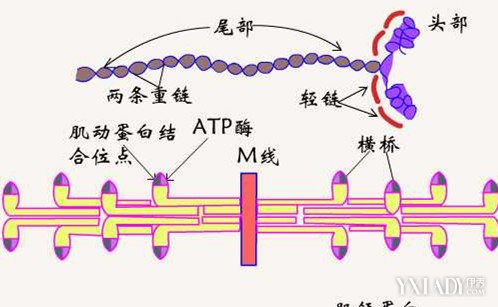

在肌原纖維蛋白結構方面的研究主要有簡華君研究了pH對豬肉肌原纖維蛋白二級結構α-螺旋及其熱誘導凝膠硬度、保水性及微觀結構的影響。得到隨著 pH 偏離肌原纖維蛋白等電點向中性範圍靠近,其 α-螺旋含量及其熱誘導凝膠的保水性都逐漸增大;而凝膠硬度在pH6.0 時達最大值;在遠離等電點的中性條件下,肌原纖維蛋白凝膠具有較高有序性的微觀結構,而且結構均勻,酸性條件下凝膠的微觀結構有序性低,不均勻,且存在聚合物。豬肉肌原纖維蛋白 α-螺旋含量與其熱誘導凝膠保水性呈正相關關係;蛋白含天然結構 α-螺旋較多時,凝膠微觀結構比較有序。
國外研究現狀
歐美和日本一些國家從 20 世紀 70 年代開始研究肌原纖維蛋白的一些功能性質,並取得了良好的進展。國外關於肌原纖維蛋白主要是在肉製品中、研究不同條件下對肌原纖維蛋白的變性程度進行了研究進而影響肉製品的品質。
在日本主要把肌原纖維蛋白 ATP 酶的活性作為評多和雄趨價肌原纖維蛋白完整性的一個重要指標進行研究。Nagai 等對日本虎魚背肌肉肌原纖維蛋白的理化性質進行了研究。重酶解肌球蛋白 Ca-ATP 酶的活性高於肌球蛋白 Ca-ATP 酶活性,而 EDTA-ATP 酶活性和Mg-ATP 酶活性與肌球蛋白的酶活性一樣。在 4℃儲存時重酶解肌球蛋白比肌球蛋白相比較為穩定,對每個部分進行 DSC 測定其變溫度為:肌球蛋白為 40.9℃,肌動蛋白為 61.1℃,重酶解肌球蛋白為 40.9 和 59.3℃,輕店戒酶解肌球蛋白為 62.2℃。當肌球蛋白用胰蛋白酶酶解時,頭部分有 ATP 酶活性。輕酶解肌球蛋白和中部沒有 ATP 酶活性。用胰蛋白酶酶解肌球蛋白得到具有 ATP 酶活性的部分具有很高的熱敏感性。此外,在肌原纖維蛋白中添加幾丁質水解物來研究肌原纖維蛋白的穩定性。例如 Yamashita等研究了幾丁質水解物對蜥蜴魚肌原纖維蛋白的影響。在-25℃凍藏 120 天,幾丁質水解物除了明顯降低的肌原纖維蛋白 Ca- ATP 酶活性。幾丁質水解物通過抑制之間的肌原纖維蛋白和幾丁質水解物 OH 基團水化層相互作用增強了肌原纖維蛋白穩定性。
此外,在貯藏過程中研究肌原纖維蛋白與其他蛋白的相互影響,並且以水作為一個評價指標來研究。例如:Hossain 等研究了冷凍對狗母魚肌原纖維蛋白的影響。在-25℃對肌原纖維蛋白冷水 90 天后得到,添加 5.0%-7.5%的魷魚蛋白水解物來提高肌原纖維蛋白中未凍水分的量,降低肌原纖維蛋白的變性程度。
在歐美主要對肌原纖維蛋白熱力學和熱塑性方面研究,Cuq 等對魚類肌原纖維蛋白的熱塑性特性研究,並進行動態熱力學分析。在動態力學性能變化中,觀察到溫度升高對魚肌原纖維蛋白的玻璃化轉變影響。肌原纖維蛋白乾燥物質在 215 和 250℃玻璃態-橡膠態之間的過渡。添加蔗糖或山梨醇使肌原纖維蛋白玻璃化轉變溫度顯著下降。
在肌原纖維蛋白結構方面的研究主要有簡華君研究了pH對豬肉肌原纖維蛋白二級結構α-螺旋及其熱誘導凝膠硬度、保水性及微觀結構的影響。得到隨著 pH 偏離肌原纖維蛋白等電點向中性範圍靠近,其 α-螺旋含量及其熱誘導凝膠的保水性都逐漸增大;而凝膠硬度在pH6.0 時達最大值;在遠離等電點的中性條件下,肌原纖維蛋白凝膠具有較高有序性的微觀結構,而且結構均勻,酸性條件下凝膠的微觀結構有序性低,不均勻,且存在聚合物。豬肉肌原纖維蛋白 α-螺旋含量與其熱誘導凝膠保水性呈正相關關係;蛋白含天然結構 α-螺旋較多時,凝膠微觀結構比較有序。
國外研究現狀
歐美和日本一些國家從 20 世紀 70 年代開始研究肌原纖維蛋白的一些功能性質,並取得了良好的進展。國外關於肌原纖維蛋白主要是在肉製品中、研究不同條件下對肌原纖維蛋白的變性程度進行了研究進而影響肉製品的品質。
在日本主要把肌原纖維蛋白 ATP 酶的活性作為評價肌原纖維蛋白完整性的一個重要指標進行研究。Nagai 等對日本虎魚背肌肉肌原纖維蛋白的理化性質進行了研究。重酶解肌球蛋白 Ca-ATP 酶的活性高於肌球蛋白 Ca-ATP 酶活性,而 EDTA-ATP 酶活性和Mg-ATP 酶活性與肌球蛋白的酶活性一樣。在 4℃儲存時重酶解肌球蛋白比肌球蛋白相比較為穩定,對每個部分進行 DSC 測定其變溫度為:肌球蛋白為 40.9℃,肌動蛋白為 61.1℃,重酶解肌球蛋白為 40.9 和 59.3℃,輕酶解肌球蛋白為 62.2℃。當肌球蛋白用胰蛋白酶酶解時,頭部分有 ATP 酶活性。輕酶解肌球蛋白和中部沒有 ATP 酶活性。用胰蛋白酶酶解肌球蛋白得到具有 ATP 酶活性的部分具有很高的熱敏感性。此外,在肌原纖維蛋白中添加幾丁質水解物來研究肌原纖維蛋白的穩定性。例如 Yamashita等研究了幾丁質水解物對蜥蜴魚肌原纖維蛋白的影響。在-25℃凍藏 120 天,幾丁質水解物除了明顯降低的肌原纖維蛋白 Ca- ATP 酶活性。幾丁質水解物通過抑制之間的肌原纖維蛋白和幾丁質水解物 OH 基團水化層相互作用增強了肌原纖維蛋白穩定性。
此外,在貯藏過程中研究肌原纖維蛋白與其他蛋白的相互影響,並且以水作為一個評價指標來研究。例如:Hossain 等研究了冷凍對狗母魚肌原纖維蛋白的影響。在-25℃對肌原纖維蛋白冷水 90 天后得到,添加 5.0%-7.5%的魷魚蛋白水解物來提高肌原纖維蛋白中未凍水分的量,降低肌原纖維蛋白的變性程度。
在歐美主要對肌原纖維蛋白熱力學和熱塑性方面研究,Cuq 等對魚類肌原纖維蛋白的熱塑性特性研究,並進行動態熱力學分析。在動態力學性能變化中,觀察到溫度升高對魚肌原纖維蛋白的玻璃化轉變影響。肌原纖維蛋白乾燥物質在 215 和 250℃玻璃態-橡膠態之間的過渡。添加蔗糖或山梨醇使肌原纖維蛋白玻璃化轉變溫度顯著下降。