基本介紹
分布,元素性質,周期律性質,矽的特殊性,化學性質,化學反應,重要性質,參見,
分布
碳族元素中,矽的豐度最大,僅次於氧;碳、矽都是地殼中的常量元素;錫、鉛的豐度較小,但礦藏集中,易於開採和冶煉,因而其歷史也較為長久;鍺屬於稀散型稀有金屬,礦藏極少;鈇主要是人工合成。
元素性質
周期律性質
主條目:元素周期律
碳族元素表現出一定的周期性,從上到下,元素的金屬性增強,非金屬性減弱,+4價化合物穩定性降低,+2價化合物穩定性提高,鉛(Ⅱ)化合物穩定性高於鉛(Ⅳ)。
⒈相似性
·最外層都有4個電子,化合價主要有+4和+2,易形成共價化合物。
·氣態氫化物的通式:RH4
·最高價氧化物對應的水化物通式為H2RO3或R(OH)4
⒉遞變性
·+2價化合物主要氧化態穩定性逐漸增大,+4價化合物主要氧化態穩定性逐漸減小

·熔沸點降低,單質密度逐漸增大
·金屬性增強,非金屬性減弱,最高價氧化物對應水化物的酸性減弱,氫化物的穩定性減弱
矽的特殊性
主條目:對角線規則
①矽與ⅢA族的硼在周期表中處於對角線位置,表現出特有的對角線規則。而其他碳族元素無此規律。
②碳的氫化物類型眾多(例如各種烴類),而矽的氫化物類型較少
碳族元素形成的MH4 型氫化物中,CH4的生成焓為負值,其他均為正值如下表
CH4 | SiH4 | GeH4 | SnH4 | PbH4 | |
生成焓 | -74.9 | 34.3 | 90 | 163 | 正值 |
因此,CH4最為穩定,其它由上到下穩定性逐漸降低。且由於碳原子的半徑較小,可以形成碳碳雙鍵(烯烴)、三鍵(炔烴);而矽原子的半徑較大,矽與矽原子之間雙鍵型的氫化物(H2Si=SiH2)直到1981年才製得,極不穩定。
③碳的含氧酸鹽很少,而矽的含氧酸鹽類型眾多。
矽酸根離子具有正四面體結構,極其穩定,因而有許多正矽酸鹽;四面體共用單元頂點氧原子連線形成各種各樣的結構形式。
化學性質
碳可以跟濃硫酸、硝酸反應,被氧化成二氧化碳,不與鹽酸作用。矽不跟鹽酸、硫酸、硝酸作用,只與氫氟酸反應。鍺不和稀鹽酸、稀硫酸反應,但能被濃硫酸、濃硝酸氧化。錫和稀鹽酸、稀硫酸反應,生成低價錫(Ⅱ)的化合物;跟濃H2SO4、濃HNO3反應生成高價錫(Ⅳ)的化合物。鉛跟鹽酸、硫酸、硝酸都能反應被氧化成亞鉛離子。碳族元素中跟鹼溶液反應的有矽和錫,它們既表現出金屬性又表現出非金屬性。碳族元素在加熱時都能跟氧反應,被氧化成二氧化碳、二氧化矽和氧化亞鉛等。碳族元素跟硫、氯共熱生成相應的高價氯化物和硫化物,鉛則生成鉛(Ⅱ)化合物。碳、矽跟金屬共熱生成碳化物和矽化物,錫、鉛與金屬形成合金。都不能直接與氫化合,其氫化物是間接製得的。
化學反應
C + O2——→CO2
2C + O2——→ 2CO
2CO + O2——→2CO2
C+ 2CuO ——→2Cu + CO2↑
3C+ 2Fe2O3——→4Fe + 3CO2↑
CO+ CuO——→Cu + CO2
3CO+ Fe2O3——→2Fe + 3CO2
2NaOH + CO2——→Na2CO3+ H2O
2NaOH + SO2——→Na2SO3+ H2O
2NaOH + SO3——→Na2SO4+ H2O
Ca(OH)2 + CO2——→CaCO3 ↓+ H2O
Ca(OH)2+ SO2——→CaSO3↓+ H2O
CO2+ H2O——→H2CO3
C+ H2O——→CO + H2(生成水煤氣)
C+CO2——→2CO
2C+ SiO2——→2CO↑ + Si
Si +O2——→SiO2
2F2+ Si——→SiF4
Si + 4HF——→SiF4↑+2H2↑
Si+2NaOH+ H2O——→Na2SiO3+2H2↑
SiO2+2NaOH——→Na2SiO3+H2O
SiO2+ 4HF——→SiF4+2H2O
CaO+ SiO2——→CaSiO3
SiO2+ Na2CO3——→Na2SiO3+ CO2
SiO2+ CaCO3——→CaSiO3+ CO2↑
Na2SiO3+ 2HCl——→2 NaCl+ H2SiO3↓
Na2SiO3+H2O +CO2——→Na2CO3+ H2SiO3↓
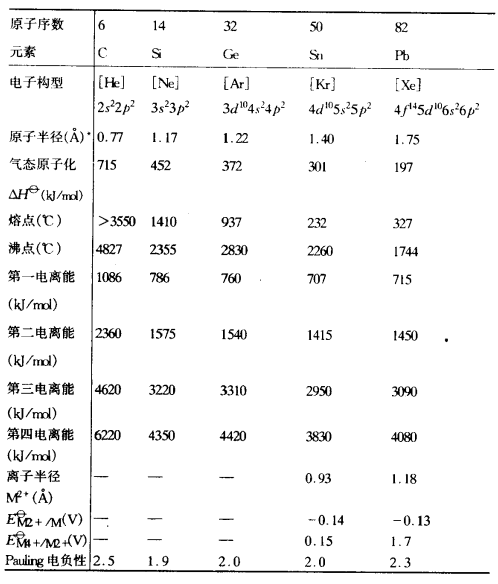
重要性質
碳族元素的一些重要性質
參見
·硼族元素(Boron group)
·氮族元素(Nitrogen group)

