引言,生物地磁導航涉及的地磁場參數,基於不同磁感受體的生物地磁導航機制模型,生物地磁導航機制涉及的磁感受分子,擴展閱讀/參考資料:,
引言
地磁場作為一個地心軸向偶極磁場,其範圍覆蓋整個地球及近地空間。地磁場不僅能夠阻擋來自宇宙空間的高能粒子輻射,還能夠對地球生物生活的大氣圈、水圈提供一個溫和環境,同時地磁場要素(地磁偏角、傾角和強度)還能為許多生物在泳動、遷徙、覓食等過程提供定位導航信息(圖1)。目前已發現許多生物如細菌、軟體動物、節肢動物及脊椎動物都能感知地磁場並利用它進行導航。

圖1 地磁場信息圖
生物地磁導航涉及的地磁場參數
地磁場是地球軸向的偶極子場,目前的地磁南極靠近地理北極,地磁北極靠近地理南極。地磁場也是矢量場,磁力線環繞地球時產生的磁傾角、磁偏角及不同磁緯度對應的磁場強度構成了可描述地球任意一點的地磁場三要素。地磁場的磁力線從南半球方向向上離開地球表面,經磁赤道處平行於地表,至北半球方向向下進入地磁北極。磁力線與地理北極在水平面內的夾角為磁偏角(D),與水平面的夾角為磁傾角(I),磁傾角在南半球由磁南極﹣90°逐漸變至磁赤道0°,在北半球又從磁赤道0°逐漸增至磁北極90°;磁場強度在地磁兩極處最大(約60 μT),磁赤道處最小(約30 μT)。
生物地磁導航需要“磁羅盤”(方向信息)和“磁地圖”(位置信息)。其中,磁力線的方向或磁傾角指示方向,是生物的定向“磁羅盤”;梯度變化的磁場則顯示不同的地表位置,提供“磁地圖”的作用。“磁羅盤”廣泛存在於魚類、兩棲類、鳥類、哺乳類等動物中,相對於“磁羅盤”的廣泛存在,“磁地圖”僅在部分物種如龍蝦(Panulirus argus)和海龜(Chelonia mydas)中得到證實:在黑暗條件下,將在棲息地抓獲的龍蝦分別送達位於棲息地不同方位的陌生環境並隔絕所有的視覺線索,發現不同實驗點的龍蝦均朝向棲息地方向移動,而運輸過程中攜帶強磁鐵則會嚴重干擾其朝棲息地移動的方位;在海龜遷徙季節,海岸線以北的海龜向南遷徙,海岸線以南的則向北遷徙,分別從海岸線南北兩側相距幾百公里的兩位點捕獲幼齡海龜,在兩位點中間設定赫姆霍茲線圈測試點模擬海龜抓獲位點的磁場。結果發現,在測試位點南抓獲的海龜一致性朝北定向,而在測試位點北抓獲的海龜則朝南定向。
基於不同磁感受體的生物地磁導航機制模型
生物地磁導航需要生物體內具備相應的磁感受體,並滿足以下條件:(1)磁感受體的功能具有長期性和穩定性;(2)受體數量充足,神經信號識別度高;(3)與中樞神經系統密切關聯。由於磁力線可以穿透生物組織,因此磁感受體不必像聽覺、視覺、味覺等感覺系統的初級感受體一樣必須分布在體表,可能分布在生物的任何部位。目前有關生物地磁導航機制主要存在兩種模型:基於磁鐵礦的模型和基於自由基對反應的化學模型。二者都具備一定的理論和實驗基礎,可能並不互相排斥。
基於磁鐵礦的生物地磁導航機制模型認為,生物體內的內源性納米級磁鐵礦顆粒能藉助細胞骨架纖絲錨定於機械激活的跨膜離子通道,在外磁場作用下,磁顆粒產生磁扭矩引起離子通道的瞬時開放,導致膜去極化形成下游級聯反應,從而傳遞磁信號(圖2)。趨磁細菌、蜜蜂、螞蟻、蝴蝶、稻飛虱、鮭魚和鳥類等多種生物體均被發現有磁顆粒存在:趨磁細菌體內形成內源性納米磁性顆粒-磁小體(Magnetosome),很多排列成鏈,主要成分為Fe3O4和Fe3S4,其功能是地磁導向作用,即在地磁場的作用下,趨磁細菌藉助鞭毛游向對該菌最有力的泥、水界面微氧環境處生活。蜜蜂腹部的滋養細胞內平均含有8個直徑較小的磁顆粒,而每個顆粒內部又含有八千多個密集的超順磁粒子(平均粒徑為7.5 nm);對蜜蜂滋養細胞施加地磁場量級的人工磁場時可觀察到磁顆粒的變化,並伴隨著鈣離子的釋放。家鴿喙部神經樹突上的磁顆粒是由板狀磁赤鐵礦(γ-Fe2O3)結晶和簇狀磁鐵礦(超順磁Fe3O4)小粒組成,分析認為家鴿頭部相對地磁場的改變可產生0.2 pN作用力,這足以改變神經細胞膜上的離子通道狀態。水稻遷飛性害蟲稻飛虱的腹部含有納米級內源磁顆粒(粒徑50-450nm;主要成分為Fe3O4)。該內源磁顆粒在稻飛虱若蟲及長、短翅型成蟲體內均有發現,且長翅型雌成蟲體內磁顆粒含量最高,暗示其在稻飛虱遷飛中的潛在功能。
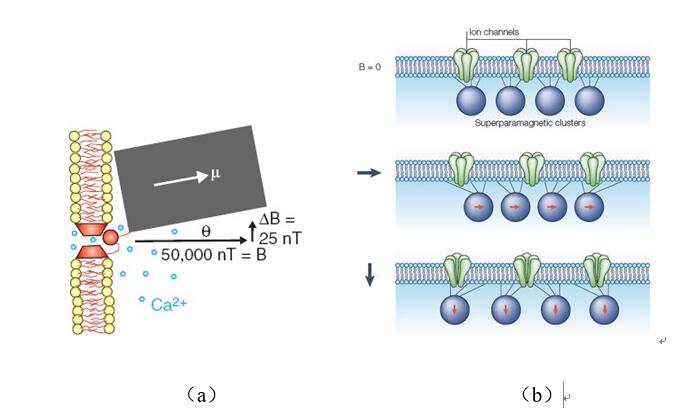
圖2 基於磁鐵礦的生物地磁導航機制模型(a)磁扭矩(b)超順磁顆粒
基於自由基對化學反應的生物地磁導航機制模型認為,在特定波長的光照刺激下,生物體內的特定光受體發生電子轉移,產生了臨時配對的自由基對,而地磁場量級的磁場變化可以通過塞曼互動作用影響自由基對的自旋狀態, 使得不同磁場條件下生成的單-三重激發態具有不同的平衡比,從而使生物體在第一時間感受到磁場特徵信息的變化(圖3)。其中,藍光/ UV光受體隱花色素在光依賴的磁感受機制中發揮重要作用。隱花色素亦稱為藍光受體,為DNA光複合酶/隱花色素黃素蛋白家族成員,在生物體內廣泛存在。研究表明,在自然光或短光波長條件下,果蠅對磁場方向的選擇表現原始的或接受磁訓練的兩種偏好性, 而濾掉果蠅選擇環境中的隱花色素光譜或果蠅體內的隱花色素缺陷、不足,均導致果蠅喪失以上兩種磁場選擇偏好性;將人的隱花色素基因Cry2導入隱花色素缺失的果蠅中,果蠅則表現光依賴的磁場選擇性。由此說明,隱花色素可能是生物體內的光依賴磁感受分子。
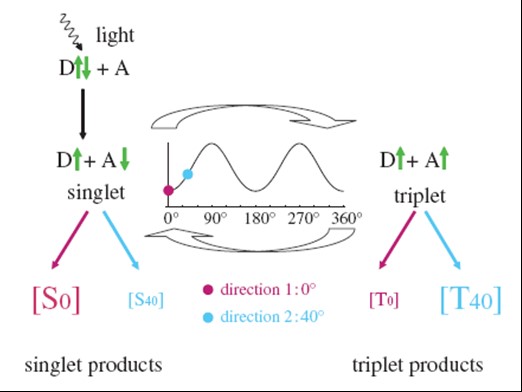
圖3基於自由基對化學反應的生物地磁導航機制模型
生物地磁導航機制涉及的磁感受分子
隱花色素作為光依賴的生物磁感受分子得到了越來越多的數據支持。在視覺信息處理過程中,隱花色素具有受光激發產生激發態自由基對的重要化學性質,而視蛋白雖然能通過吸收光能改變自身構型,但不能產生激發態自由基電子對,因此不可能是光依賴的磁感受分子。隱花色素蛋白的光激活可能是一個循環過程:黑暗條件下,隱花色素的輔酶黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)處於氧化態FADox,對應的氧化型隱花色素蛋白Cry1a處於無活性狀態,經紫外光及藍光等短波長的光還原後轉化為半醌態,半醌態的FAD與色氨酸 (Trp)形成FADH/Trp自由基對,該自由基對在無光條件下可被再次氧化為FADox.。在光照條件下,則吸收紫外光、藍光、綠光,還原為FADH,此時隱花色素蛋白Cry1a發生構象改變而被激活,在不依賴光的條件下被再次氧化生成自由基對FADH/O2﹣,完成循環。
鐵硫簇蛋白(Iron-sulfur cluster assembly protein 1, IscA1;又名Magnetoreceptor, MagR)作為近期發現的生物磁感受分子,不斷引起關注。MagR能夠通過線性多聚化組裝,形成一個棒狀的具有磁偶極的蛋白質複合物,而隱花色素蛋白Cry通過相互作用,纏繞在MagR棒狀多聚蛋白的外圍,實現理論上的“光磁耦合”(圖4)。MagR蛋白複合體的每一蛋白單體都結合了一個二鐵二硫形式的鐵硫簇,具有明顯的內稟磁矩,可以通過磁場富集和純化。實際上,鐵硫簇蛋白屬於進化中非常古老的蛋白家族,很多高等生物中的鐵硫簇蛋白在細菌中也廣泛存在,編碼該蛋白的磁受體基因magr從昆蟲到人類高度保守,意味著生物磁感受機制可能比較保守。
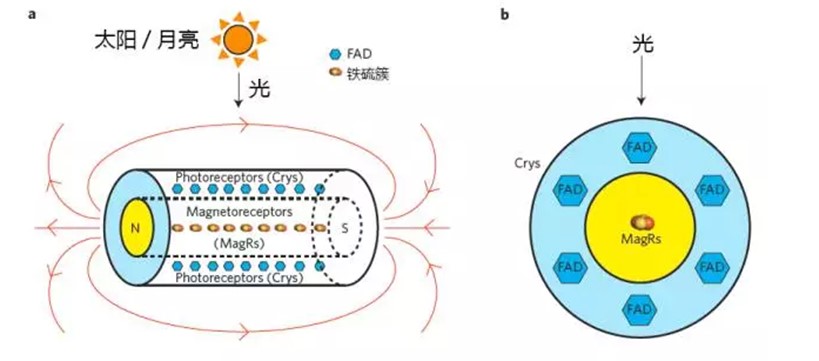
圖4 鐵硫簇蛋白(MagR)/隱花色素蛋白(Cry)複合體的生物羅盤分子結構
擴展閱讀/參考資料:
- 潘永信, 朱日祥. 2011. 生物地球物理學的產生與研究進展. 科學通報, 56(17): 1335-1344.
- Wei Y, Pu Z Y, Zong Q G, et al. 2014. Oxygen escape from the Earth during geomagnetic reversals: Implications to mass extinction. Earth and Planetary Science Letters, 394: 94-98.
- Wiltschko R, Wiltschko W. 2012. Magnetoreception∥López-Larrea C. Sensing in Nature. US: Springer, 126-141.
- Skiles D D. 1985. The geomagnetic field its nature, history, and biological relevance∥Kirschvink J L, Jones D S, MacFadden B J. Magnetite Biomineralization and Magnetoreception in Organisms. New York,US: Springer, 43-102.
- Mouritsen H. 2013. The magnetic senses∥Galizia C G, Lledo P M. Neurosciences-From Molecule to Behavior: a University Textbook. Berlin,Germany: Springer, 427-443.
- 朱崗昆. 2005. 古地磁學--基礎、原理、方法、成果與套用. 北京: 科學出版社, 101.
- Wiltschko R, Wiltschko W. 1995. Magnetic Orientation in Animals. New York,US: Springer Press, 43-98.
- Lohmann K J. 2010. Q&A: Animal behaviour: Magnetic-field perception. Nature, 464(7292): 1140-1142.
- Boles L C, Lohmann K J. 2003. True navigation and magnetic maps in spiny lobsters. Nature, 421(6918): 60-63.
- Lohmann K J, Lohmann C M F, Ehrhart L M, et al. 2004. Animal behaviour: geomagnetic map used in sea-turtle navigation. Nature, 428(6986): 909-910.
- Mouritsen H, Ritz T. 2005b. Magnetoreception and its use in bird navigation. Current Opinion in Neurobiology, 15(4): 406-414.
- 劉小峰, 史遠. 2009. 鳥類磁感受的生物物理機制研究進展. 生物物理學報, 25(4): 247-254.
- Blakemore R. 1975. Magnetotactic bacteria. Science, 190(4212): 377-379.
- Mann S, Sparks NH, Walker MM, Kirschvink JL. Ultrastructure, morphology and organization of biogenic magnetite from sockeye salmon, Oncorhynchus nerka: Implications for magnetoreception. J. Exp. Biol., 1988, 140: 35-49.
- Hanzlik M, Heunemann C, Holtkamp-Rötzler E, Winklhofer M, Petersen N, Fleissner G. Superparamagnetic magnetite in the upper beak tissue of homing pigeons. Biometals, 2000, 13(4): 325-331.
- Cadiou H, McNaughton PA. Avian magnetite-based magnetoreception: A physiologist's perspective. J. R. Soc. Interface, 2010, 7(Suppl 2): S193-S205.
- Eder SH, Cadiou H, Muhamad A, McNaughton PA, Kirschvink JL, Winklhofer M. Magnetic characterization of isolated candidate vertebrate magnetoreceptor cells. Proc. Natl Acad. Sci. USA, 2012, 109(30): 12022-12027.
- Kirschvink J L, Walker M M, Diebel C E. 2001. Magnetite-based magnetoreception. Current Opinion in Neurobiology, 11(4): 462-467.
- Johnsen S, Lohmann K J. 2005. The physics and neurobiology of magnetoreception. Nature Reviews Neuroscience, 6, 703-712.
- Hsu CY, Li CW. Magnetoreception in honeybees (Apis mellifera). Science, 1994, 265(5168): 95-97.
- Fleissner G, Stahl B, Thalau P, Falkenberg G, Fleissner G. A novel concept of Fe-mineral-based magnetoreception: Histological and physicochemical data from the upper beak of homing pigeons. Naturwissenschaften, 2007, 94(8): 631-642.
- Pan WD, Wan GJ, Xu JJ, Li XM, Liu YX, Qi LP, Chen FJ. Evidence for the presence of biogenic magnetic particles in the nocturnal migratory brown planthopper, Nilaparvata lugens. Sci.Rep.,2016, 6:18771, doi:10.1038/srep18771.
- Ritz T, Adem S, Schulten K. 2000. A model for photoreceptor-based magnetoreception in birds. Biophysical Journal, 78(2): 707-718.
- Maeda K, Henbest KB, Cintolesi F, Kuprov I, Rodgers CT, Liddell PA, Gust D, Timmel CR, Hore PJ. Chemical compass model of avian magnetoreception. Nature, 2008, 453(7193): 387-390.
- Rodgers CT, Hore PJ. Chemical magnetoreception in birds: The radical pair mechanism. Proc. Natl Acad. Sci. USA, 2009, 106(2): 353-360.
- Solov'yov IA, Mouritsen H, Schulten K. Acuity of a cryptochrome and vision-based magnetoreception system in birds. Biophys. J., 2010, 99(1): 40-49.
- Cai J, Plenio MB. Chemical compass model for avian magnetoreception as a quantum coherent device. Phys. Rev. Lett., 2013, 111(23): 230503.
- Gegear RJ, Casselman A, Waddell S, et al. 2008. Cryptochrome mediates light-dependent magnetosensitivity in Drosophila. Nature, 454(7207): 1014-1018.
- Lu Y, Song T. Avian magnetoreception model realized by coupling magnetite-based mechanism with radical-pair-based mechanism. Chinese Physics B. 2013, 22 (4): 048701.
- Foley LE, Gegear R J, Reppert S M. 2011. Human cryptochrome exhibits light-dependent magnetosensitivity. Nature Communications, 2(6): 356.
- Nießner C, Denzau S, Stapput K, et al. 2013. Magnetoreception: activated cryptochrome 1a concurs with magnetic orientation in birds. Journal of the Royal Society Interface, 10(88): 20130638.
- Qin SY, Yin H, Yang CL, Dou YF, Liu ZM, Zhang P, Yu H, Huang YL, Feng J, Hao JF, Hao J, Deng LZ, Yan XY, Dong XL, Zhao ZX, Jiang TJ, Wang HW, Luo SJ, Xie C. A magnetic protein biocompass. Nat. Mater., 2016, 15(2): 217-226.
