注射用雷替曲塞,用於晚期結直腸癌患者。
基本介紹
- 藥品名稱:注射用雷替曲塞
- 藥品類型:處方藥
- 用途分類:其他抗腫瘤藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,臨床試驗,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
本品活性成份為雷替曲塞;其化學名稱:N-[5-[N-甲基-N-(2-甲基-4-氧代-3,4-二氫喹唑啉-6-基甲基)氨基]-2-噻吩甲醯基]-L-谷氨酸
化學結構式:
化學結構式:
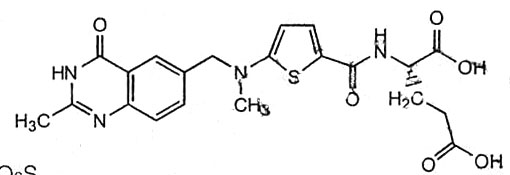
分子式:C21H22N4O6S
分子量:458.49
輔料:甘露醇、磷酸氫二鈉及氫氧化鈉。
性狀
本品為白色或類白色疏鬆塊狀物或粉末。
適應症
在患者無法接受聯合化療時,本品可單藥用於治療不適合5-FU/亞葉酸鈣的晚期結直腸癌患者。
規格
2 mg。
用法用量
成人:推薦劑量為3mg-m2,用50-250ml0.9%氯化鈉注射液或5%葡萄糖注射液溶解稀釋後靜脈輸注,給藥時間15分鐘,如果未出現毒性,可考慮按上述治療每3周重複給藥1次。本藥應避免與其它藥物混合輸注。
增加劑量會致使危及生命或致死性毒性反應的發生率升高,所以不推薦劑量大於3mg/m2。
每次用藥治療前需檢查全血細胞計數(包括白細胞分類計數和血小板計數)加肝、腎功能。治療前應該白細胞計數>4.0×109/L、中性粒細胞計數>2.0×109/L和血小板計數>1.0×1011/L。出現毒性反應時,下一周期用藥需延遲至不良反應消退;尤其是胃腸道毒性(腹瀉或黏膜炎)及血液學毒性(中性粒細胞減少或血小板減少)需完全恢復才可進行後續治療。出現胃腸道毒性者應至少每周檢查一次全血細胞計數以監測血液學毒性。
根據前一治療周期觀察到的最嚴重的胃腸道及血液學毒性等級,如果此類毒性已完全緩解,推薦按前一周期最嚴重的胃腸道、血液學毒性(以下毒性均按WHO標準分級)進行劑量調整:
劑量減少25%:血液學毒性(中性粒細胞減少或者血小板減少)3級或胃腸道毒性2級(腹瀉或黏膜炎);
劑量減少50%:血液學毒性(中性粒細胸減少或者血小板減少)4圾或胃腸道毒性3級(腹瀉或黏膜炎)。
一旦減量,後續治療的劑量也須按減量後給藥。
出現4級胃腸道毒(腹瀉或黏膜炎),或3級胃腸道毒性伴4級血液學毒性時必須中止治療;同時迅速給予標準支持治療,包括靜脈補水和造血功能支持。臨床前研究提示可以使用亞葉酸治療,按照臨床經驗需每6小時靜脈注射25mg/m2亞葉酸直至症狀緩解。對於此類患者建議停用本藥。
腎功能不全:血清肌酐異常者,每次用藥治療前應監測肌酐清除率。對於因年齡或體重下降等因素使血清肌酐可能與肌酐清除率相關性不好而血清肌酐正常的患者,應按相同程式操作。如果肌酐清除率<65ml/min,作如下劑量調整:
肌酐清除率 以3mg/m2的%調整劑量 給藥間隔
>65ml/min 100% 3周
55-65ml/min 75% 4周
25-54ml/min 50% 4周
<25ml/min 停止治療 不適用
肝功能不全:對於輕到中度的肝功能損害患者不需調整劑量,但是因為部分藥物經烘便排出(見藥代動力學),且這些患者預後較差,故應慎用本藥。本藥未在重度肝功能損害患者中進行研究,因此對於顯性黃疸或肝功能失代償的患者不推薦使用。
增加劑量會致使危及生命或致死性毒性反應的發生率升高,所以不推薦劑量大於3mg/m2。
每次用藥治療前需檢查全血細胞計數(包括白細胞分類計數和血小板計數)加肝、腎功能。治療前應該白細胞計數>4.0×109/L、中性粒細胞計數>2.0×109/L和血小板計數>1.0×1011/L。出現毒性反應時,下一周期用藥需延遲至不良反應消退;尤其是胃腸道毒性(腹瀉或黏膜炎)及血液學毒性(中性粒細胞減少或血小板減少)需完全恢復才可進行後續治療。出現胃腸道毒性者應至少每周檢查一次全血細胞計數以監測血液學毒性。
根據前一治療周期觀察到的最嚴重的胃腸道及血液學毒性等級,如果此類毒性已完全緩解,推薦按前一周期最嚴重的胃腸道、血液學毒性(以下毒性均按WHO標準分級)進行劑量調整:
劑量減少25%:血液學毒性(中性粒細胞減少或者血小板減少)3級或胃腸道毒性2級(腹瀉或黏膜炎);
劑量減少50%:血液學毒性(中性粒細胸減少或者血小板減少)4圾或胃腸道毒性3級(腹瀉或黏膜炎)。
一旦減量,後續治療的劑量也須按減量後給藥。
出現4級胃腸道毒(腹瀉或黏膜炎),或3級胃腸道毒性伴4級血液學毒性時必須中止治療;同時迅速給予標準支持治療,包括靜脈補水和造血功能支持。臨床前研究提示可以使用亞葉酸治療,按照臨床經驗需每6小時靜脈注射25mg/m2亞葉酸直至症狀緩解。對於此類患者建議停用本藥。
腎功能不全:血清肌酐異常者,每次用藥治療前應監測肌酐清除率。對於因年齡或體重下降等因素使血清肌酐可能與肌酐清除率相關性不好而血清肌酐正常的患者,應按相同程式操作。如果肌酐清除率<65ml/min,作如下劑量調整:
肌酐清除率 以3mg/m2的%調整劑量 給藥間隔
>65ml/min 100% 3周
55-65ml/min 75% 4周
25-54ml/min 50% 4周
<25ml/min 停止治療 不適用
肝功能不全:對於輕到中度的肝功能損害患者不需調整劑量,但是因為部分藥物經烘便排出(見藥代動力學),且這些患者預後較差,故應慎用本藥。本藥未在重度肝功能損害患者中進行研究,因此對於顯性黃疸或肝功能失代償的患者不推薦使用。
不良反應
(一)國外臨床試驗信息
與其他細胞毒性藥物相似,雷替曲塞的主要不良反應包括對胃腸道、血液系統及肝酶的可逆性影響。
胃腸道系統
最常見的不良反應為噁心(58%)、嘔吐(37%)、腹瀉(38%)和食欲不振(28%)。較少見的不良反應包括黏膜炎、口炎(包括口腔潰瘍)、消化不良和便秘,有報導胃腸道出血可能與黏膜炎和/或血小板減少有關。
腹瀉通常為輕或中度(WHO1/2級),可發生於雷替曲塞給藥後任何時間,也有可能發生重度腹瀉(WHO3/4級),且可能與並發的骨髓毒性尤其是白細胞減少(特別是中性粒細胞減少)有關。可停止給藥或根據毒性反應的等級降低劑量(見用法用量)。
噁心和嘔吐通常為輕度(WHO1/2級),常於用藥一周內發生,可用止吐藥治療。
造血系統
可能與藥物有關的不良反應為白細胞減少(特別是中性粒細胞減少)、貧血和血小板減少(發生率分別為22%、18%和5%),可單獨發生或同時發生,這些反應通常為輕到中度(WHO1/2級),於用藥後第1或2周內發生,第3周前恢復。也有可能發生重度(WHO3/4級)白細胞減少(特別是中性粒細胞減少)和WHO4級的血小板減少,可能會危及生命或致命,尤其與胃腸道毒性反應同時發生時。
肝臟
常見AST和ALT的可逆性升高(發生率分別為16%和14%),當這些變化與潛在的惡性腫瘤的進展無關時,通常表現為無症狀和自限性。其他較少見的不良反應包括體重下降、脫水、外周性水腫、高膽紅素血症和鹼性磷酸酶升高。
心血管系統
據報導,在治療晚期結直腸癌臨床試驗中一些患者出現心律和心功能異常,包括竇性心動過速、室上性心動過速到房顫和充血性心衰。使用雷替曲塞治療的患者心律及心功能異常的發生率分別為2.8%和1.8%,而對照組患者的發生率分別為1.9%和1.4%。由於多數異常與潛在的情狀如敗血症及脫水同時發生,且治療前超過三分之—的患者已發生心血管異常,故不能確定與給藥間的因果關係。
肌肉骨骼和神經系統
小於2%的患者可發生關節痛和張力過強(通常為肌痙攣)等不良反應。
皮膚、附屬檔案和特殊感官
皮疹較為常見(發生率14%),有時伴有瘙癢,其他較少見的反應有脫皮、脫髮、出汗、味覺異常和結膜炎。
全身
乏力最為常則(發生率49%)和發熱(發生率22%),通常為輕到中度,在用藥一周內發生,且可逆。有可能發生重度乏力並伴有身體不適和流感樣症狀,其他較少見的反應為腹痛、疼痛、頭痛、蜂窩織炎和敗血症。
以下為臨床試驗中結直腸癌患者使用雷替曲塞治療時發生率為2%或以上可能與藥物有關的不良反應。
表1結直腸癌臨床試驗中使用3mg/m2雷替曲塞治療的患者發生率至少為2%的下藥物相關的的不良事件
與其他細胞毒性藥物相似,雷替曲塞的主要不良反應包括對胃腸道、血液系統及肝酶的可逆性影響。
胃腸道系統
最常見的不良反應為噁心(58%)、嘔吐(37%)、腹瀉(38%)和食欲不振(28%)。較少見的不良反應包括黏膜炎、口炎(包括口腔潰瘍)、消化不良和便秘,有報導胃腸道出血可能與黏膜炎和/或血小板減少有關。
腹瀉通常為輕或中度(WHO1/2級),可發生於雷替曲塞給藥後任何時間,也有可能發生重度腹瀉(WHO3/4級),且可能與並發的骨髓毒性尤其是白細胞減少(特別是中性粒細胞減少)有關。可停止給藥或根據毒性反應的等級降低劑量(見用法用量)。
噁心和嘔吐通常為輕度(WHO1/2級),常於用藥一周內發生,可用止吐藥治療。
造血系統
可能與藥物有關的不良反應為白細胞減少(特別是中性粒細胞減少)、貧血和血小板減少(發生率分別為22%、18%和5%),可單獨發生或同時發生,這些反應通常為輕到中度(WHO1/2級),於用藥後第1或2周內發生,第3周前恢復。也有可能發生重度(WHO3/4級)白細胞減少(特別是中性粒細胞減少)和WHO4級的血小板減少,可能會危及生命或致命,尤其與胃腸道毒性反應同時發生時。
肝臟
常見AST和ALT的可逆性升高(發生率分別為16%和14%),當這些變化與潛在的惡性腫瘤的進展無關時,通常表現為無症狀和自限性。其他較少見的不良反應包括體重下降、脫水、外周性水腫、高膽紅素血症和鹼性磷酸酶升高。
心血管系統
據報導,在治療晚期結直腸癌臨床試驗中一些患者出現心律和心功能異常,包括竇性心動過速、室上性心動過速到房顫和充血性心衰。使用雷替曲塞治療的患者心律及心功能異常的發生率分別為2.8%和1.8%,而對照組患者的發生率分別為1.9%和1.4%。由於多數異常與潛在的情狀如敗血症及脫水同時發生,且治療前超過三分之—的患者已發生心血管異常,故不能確定與給藥間的因果關係。
肌肉骨骼和神經系統
小於2%的患者可發生關節痛和張力過強(通常為肌痙攣)等不良反應。
皮膚、附屬檔案和特殊感官
皮疹較為常見(發生率14%),有時伴有瘙癢,其他較少見的反應有脫皮、脫髮、出汗、味覺異常和結膜炎。
全身
乏力最為常則(發生率49%)和發熱(發生率22%),通常為輕到中度,在用藥一周內發生,且可逆。有可能發生重度乏力並伴有身體不適和流感樣症狀,其他較少見的反應為腹痛、疼痛、頭痛、蜂窩織炎和敗血症。
以下為臨床試驗中結直腸癌患者使用雷替曲塞治療時發生率為2%或以上可能與藥物有關的不良反應。
表1結直腸癌臨床試驗中使用3mg/m2雷替曲塞治療的患者發生率至少為2%的下藥物相關的的不良事件
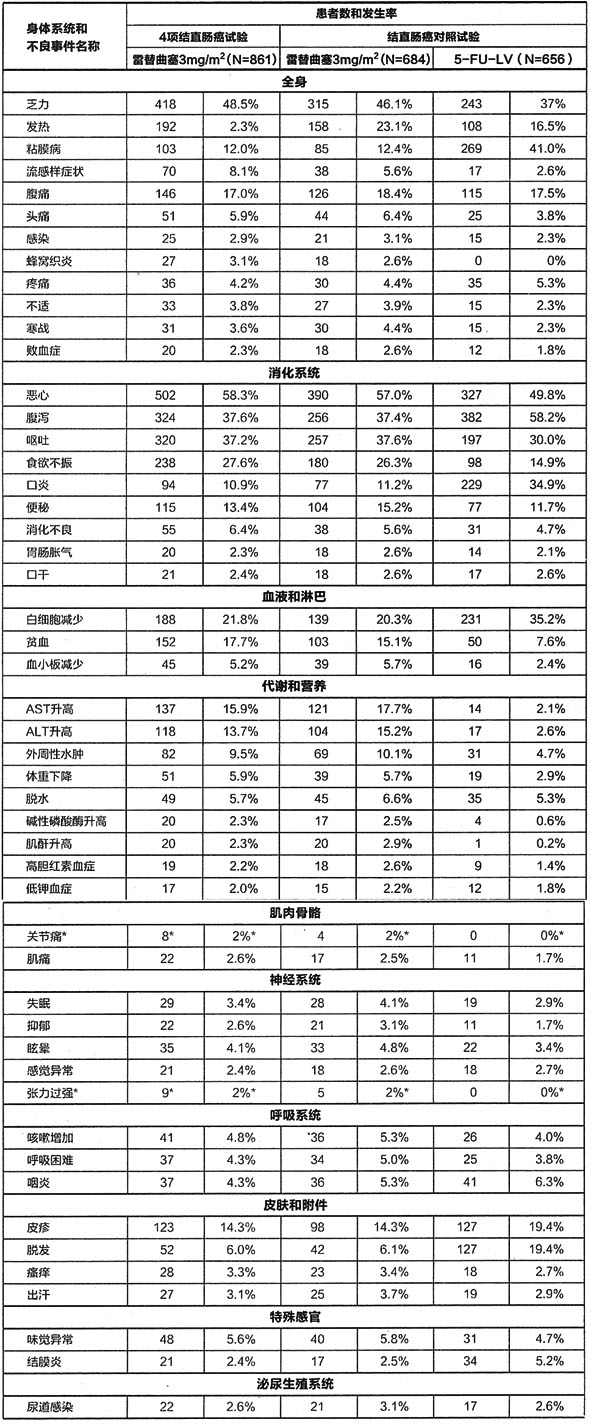
5-FU-LV為5-氟尿嘧啶和亞葉酸
*這些值為2項臨床試驗結果(IL/002和IL/003研究),如按4項臨床試驗計算發生率則低於2%。
下表為至少2%患者發生的WHO3/4級不良事件的發生率
表2 WHO3/4級不良事件(發生率2%或以上)
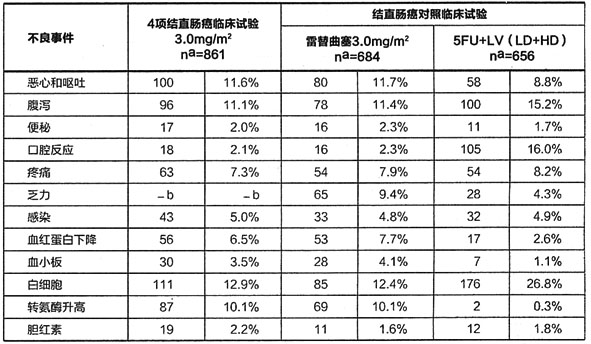
a:“n”為患者總數b:此不良反應沒有報導
下表列出在4項結直腸癌臨床試驗中報導中的嚴重不良事件數量,包括將住院治療作為嚴重不良事件的標準。參加這些臨床試驗的患者中總計有37%的患者經歷過1次包括住院治療的嚴重不良事件。
表3 1694IL/0002C、1694IL/0003、1694IL/0010和1694IL/0012
臨床試驗中將住院治療作為嚴重標準的SAEs件數
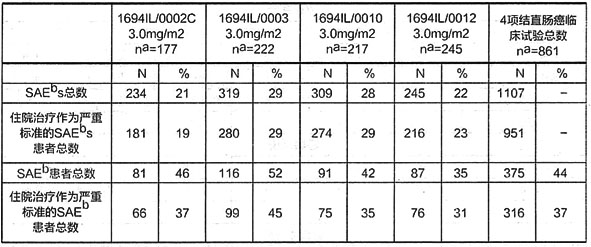
a:“n”為患者總數b:SAE為嚴重不良反應事件
(二)國內臨床試驗信息
在國內進行了一項多中心,隨機盲法、陽性藥物平行對照的臨床研究,評價注射用雷替曲塞(3mg/m2)聯台奧沙利鉑(13mg/m2)(21天重複)與5-FU/CF(375mg/m2/200mg/m2)聯合奧沙利鉑(130mg/m2)(21天重複)比較治療局部晚期或轉移性結直腸癌患者的療效和安全性。本試驗入組患者216例,試驗組113例。分析安全集(SS)214例,試驗組112例。
國內臨床試驗顯示本品聯合奧沙利鉑的不良反應主要包括噁心、嘔吐、乏力、腹瀉、中性粒細胞減少、貧血,血小板減少、轉氨酶升高等,試驗組粒細胞減少的發生率高於對照組,但兩組因粒細胞缺乏所致的劑量調整無明顯差別,兩組使用升白藥物患者的比例相當,未發生與粒細胞減少相關的嚴重不良事件。轉氨酶升高多為I/II度,無症狀且可逆。與對照組相比III/IV度轉氨酶升高的發生率兩組間無明顯差別。
試驗組與對照組相比,噁心(57.1%/75.5%,P=0.006)、嘔吐(37.5%/60.8%,P=0.001)的發生率明顯降低。
國內臨床試驗中本品聯台奧沙鉑用藥所產生的不良事件及發生率見下表。
表4國內臨床試驗中本品聯合奧沙利鉑用藥所產生的發生率至少2%的不良事件及發生率
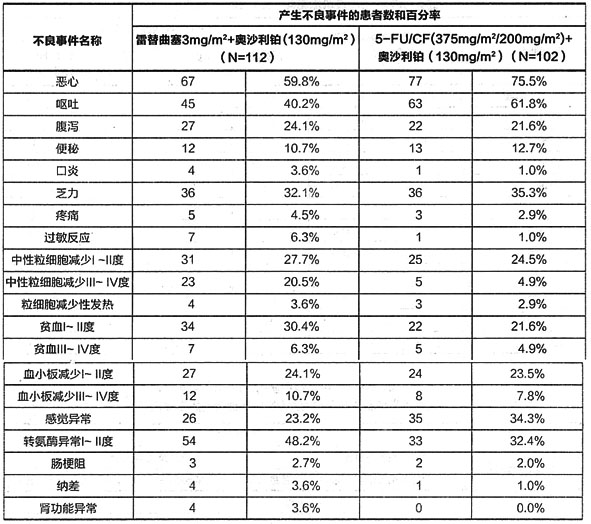
註:以上為不分任何因素(包含奧沙利鉑)所致的發生率至少為2%的全部不良事件。
禁忌
孕婦、治療期間妊娠或哺乳期婦女禁用。在使用本藥之前,應排除妊娠可能。(見孕婦哺乳期婦女用藥)重度腎功能損害者禁用。
注意事項
1、本品須由掌握腫瘤化療並能熟練處理化療相關的毒性反應的臨床醫師給藥或在其指導下使用。接受治療的患者應配合監護,以便及時發現可能的不良反應(尤其是腹瀉)並處理。
2、與其他細胞毒性藥物一樣,造血功能低下、一股狀況差、既往經放療者慎用。
3、老年患者更易出現毒性反應,尤其是胃腸道毒性(腹瀉或黏膜炎),應嚴格監護。
4、本藥部分經由糞便排(見藥代動力學),因此輕度到中度的肝功能損害者應慎用,而重度肝功能損害者不推薦使用。
5、夫妻任何一方接受本藥治療期間以及停藥後至少6個月內應避孕。
6、無藥液外滲的臨床經驗,但動物試驗時藥液外滲無明顯刺激性反應。
7、雷替曲塞系細胞毒性藥物,藥物配製及操作按同類藥物常規進行。
8、此前使用5-氟尿嘧啶治療方案疾病仍然進展患者可能會對雷替曲塞產生耐藥。
2、與其他細胞毒性藥物一樣,造血功能低下、一股狀況差、既往經放療者慎用。
3、老年患者更易出現毒性反應,尤其是胃腸道毒性(腹瀉或黏膜炎),應嚴格監護。
4、本藥部分經由糞便排(見藥代動力學),因此輕度到中度的肝功能損害者應慎用,而重度肝功能損害者不推薦使用。
5、夫妻任何一方接受本藥治療期間以及停藥後至少6個月內應避孕。
6、無藥液外滲的臨床經驗,但動物試驗時藥液外滲無明顯刺激性反應。
7、雷替曲塞系細胞毒性藥物,藥物配製及操作按同類藥物常規進行。
8、此前使用5-氟尿嘧啶治療方案疾病仍然進展患者可能會對雷替曲塞產生耐藥。
孕婦及哺乳期婦女用藥
夫妻任何一方接受本藥治療期間以及停藥後至少6個月內應避孕。
孕婦、哺乳期婦女或治療期間妊娠者禁用。用藥前需排除妊娠。
生殖試驗顯示雷替曲塞司損害雄性大鼠生殖力,停藥3個月後恢復。雷替曲塞可致孕鼠出現死胎和胚胎畸形。
孕婦、哺乳期婦女或治療期間妊娠者禁用。用藥前需排除妊娠。
生殖試驗顯示雷替曲塞司損害雄性大鼠生殖力,停藥3個月後恢復。雷替曲塞可致孕鼠出現死胎和胚胎畸形。
兒童用藥
本藥在兒童中使用的安全性和有效性尚未確立,暫不推薦。
老年用藥
參照成人的用法用量,但同其他細胞毒藥物一樣,本藥應慎用。老年患者更容易出現毒性反應。應對不良反應尤其是胃腸道毒性(腹瀉或黏膜炎)進行嚴格監護。
藥物相互作用
臨床尚未發現特殊的藥物相互作用,與葉酸、亞葉酸及包含這些成分的維生素製劑合用會降低藥物作用。所以在使用本藥前和使用本藥期間禁用此類藥物。
雷替曲塞的蛋白結合率為93%,有可能與其他蛋白結合率高的藥物發生相互作用。但體外試驗未發現與華法令有相互作用。研究顯示,腎小管主動分泌能促進雷替曲塞經腎排泄,提示本藥有可能與其他主動分泌的藥物如非甾體抗炎藥(NSAIDS)發生相互作用。但目前臨床安全性試驗未發現接受雷替曲塞治療並伴隨使用NSAIDS、華法令及其他常用藥物時出現明顯相互作用。
雷替曲塞的蛋白結合率為93%,有可能與其他蛋白結合率高的藥物發生相互作用。但體外試驗未發現與華法令有相互作用。研究顯示,腎小管主動分泌能促進雷替曲塞經腎排泄,提示本藥有可能與其他主動分泌的藥物如非甾體抗炎藥(NSAIDS)發生相互作用。但目前臨床安全性試驗未發現接受雷替曲塞治療並伴隨使用NSAIDS、華法令及其他常用藥物時出現明顯相互作用。
藥物過量
目前尚無確切有效解毒劑。一旦超量使用可考慮使用亞葉酸治療。根據經驗,每6小時靜脈注射5mq/m2亞葉酸,越晚使用亞葉酸效果越差。
超量用藥預期不良反應容易擴大。應仔細監測有關胃腸道和血液學的毒性徵兆並有針對性採取措施治療。
超量用藥預期不良反應容易擴大。應仔細監測有關胃腸道和血液學的毒性徵兆並有針對性採取措施治療。
臨床試驗
(一)國外臨床試驗
雷替曲塞治療晚期結直腸癌進行了4項關鍵的有效性試驗研究:1項在177例患者(試驗002)中進行的II期無對照研究,3項分別在439例(試驗003)、427例(試驗0010)和495例(試驗0012)患者中進行的雷替曲塞與氟尿嘧啶/亞葉酸鈣的III期對照研究。其中3項對照試驗中,2項試驗結果顯示雷替曲塞與氟尿嘧啶/亞葉酸鈣在生存期方面無統計學差異,1項試驗結果顯示有顯著性差異(p=0.01)並支持聯合使用氟尿嘧啶加亞葉酸鈣。根據所有臨床試驗中的客觀緩解率結果來看,單用雷替曲塞與氟尿嘧啶/亞葉酸鈣相似。
下表為4項研究中心療效結果的總結。
TTP=腫瘤進展時間,CF=亞葉酸鈣
所有患者均為晚期結直腸癌一線治療患者,因此無法獲得使用氟尿嘧啶加亞葉酸鈣無效而使用雷替曲塞作為二線治療晚期結直腸癌的有效性數據。
0010試驗中中位生存期為9.7個月,小於氟尿嘧啶加亞葉酸鈣組中位生存期(12.7個月),產生這種結集的混雜但非決定性的可能因素為:
1.試驗中的雷替曲塞高劑量組(4mg/m2)的早期中止導致在推薦的臨床試驗中對雷替曲塞用藥更為慎重。
2.與雷替曲塞治療相比,北美地區對氟尿嘧啶加亞葉酸鈣聯合用藥方案更為經驗。
3.氟尿嘧啶加亞葉酸鈣聯合用藥與雷替曲塞的用藥周期不同,與雷替曲塞組比較,更高比例的患者在進展期以外繼續使用氟尿嘧啶加亞葉酸鈣聯台治療。
在0010試驗和00120試驗中,雷替曲塞組患者的中位進展時間(TTP)小於接受氟尿嘧啶加亞葉酸鈣組患者。值得注意的是,與氟尿嘧啶加亞葉酸鈣的4或5周治療方案比較,對於3周治療方案的雷替曲塞組患者的疾病評估更為頻繁,從而使雷替曲塞組患者更早得到觀察,並更經常地為早期臨床進展的評估提供機會。
(二)國內臨床試驗
在國內採用多中心、隨機盲法、陽性藥物平行對照的方法,評價注射用雷替曲塞(3mg/m2)聯合奧沙利鉑(130mg/m2)(21天重複)治療局部晚期或轉移復發性結直腸癌患者的療效和安全性並與5-FU/CF(375mg/m2/200mg/m2)聯合奧沙利鉑(130mg/m2)(21天重複)治療相比較。
本試驗入組患者216例,試驗組113例。分析安全集(SS)214例,試驗組112例;FAS集和PP集均為203例,試驗組103例。
結果顯示試驗組相對照組腫瘤客觀有效率(按WHO實體瘤近期客觀療效標準CR+PR)分別為29.1%和17.0%。其中初治病例中試驗組和對照組的有效率分別為28.8%和20.8%(P=0.3368)復治病例中試驗組和對照組的有效率分別為29.4%和12.8%。
國內上述聯合用藥的臨床研究結果僅提供了該聯合方案初步臨床安全有效信息,目前尚無國內晚期結直腸癌患者單用本品的臨床研究資料,結合國外大型本品單藥臨床試驗結果考慮,可基本提示本品單藥的臨床安全性和有效性,申報單位承諾上市後進行本品單藥用於不能耐受或不適合5-Fu/亞葉酸鈣冶療的晚期結直腸癌患者的臨床研究。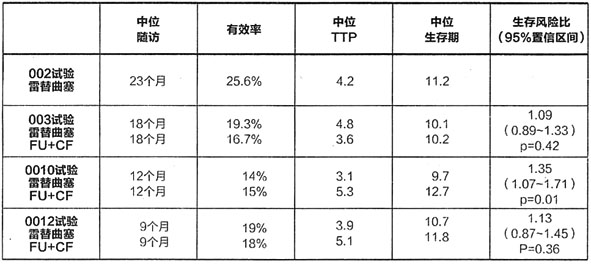
雷替曲塞治療晚期結直腸癌進行了4項關鍵的有效性試驗研究:1項在177例患者(試驗002)中進行的II期無對照研究,3項分別在439例(試驗003)、427例(試驗0010)和495例(試驗0012)患者中進行的雷替曲塞與氟尿嘧啶/亞葉酸鈣的III期對照研究。其中3項對照試驗中,2項試驗結果顯示雷替曲塞與氟尿嘧啶/亞葉酸鈣在生存期方面無統計學差異,1項試驗結果顯示有顯著性差異(p=0.01)並支持聯合使用氟尿嘧啶加亞葉酸鈣。根據所有臨床試驗中的客觀緩解率結果來看,單用雷替曲塞與氟尿嘧啶/亞葉酸鈣相似。
下表為4項研究中心療效結果的總結。
TTP=腫瘤進展時間,CF=亞葉酸鈣
所有患者均為晚期結直腸癌一線治療患者,因此無法獲得使用氟尿嘧啶加亞葉酸鈣無效而使用雷替曲塞作為二線治療晚期結直腸癌的有效性數據。
0010試驗中中位生存期為9.7個月,小於氟尿嘧啶加亞葉酸鈣組中位生存期(12.7個月),產生這種結集的混雜但非決定性的可能因素為:
1.試驗中的雷替曲塞高劑量組(4mg/m2)的早期中止導致在推薦的臨床試驗中對雷替曲塞用藥更為慎重。
2.與雷替曲塞治療相比,北美地區對氟尿嘧啶加亞葉酸鈣聯合用藥方案更為經驗。
3.氟尿嘧啶加亞葉酸鈣聯合用藥與雷替曲塞的用藥周期不同,與雷替曲塞組比較,更高比例的患者在進展期以外繼續使用氟尿嘧啶加亞葉酸鈣聯台治療。
在0010試驗和00120試驗中,雷替曲塞組患者的中位進展時間(TTP)小於接受氟尿嘧啶加亞葉酸鈣組患者。值得注意的是,與氟尿嘧啶加亞葉酸鈣的4或5周治療方案比較,對於3周治療方案的雷替曲塞組患者的疾病評估更為頻繁,從而使雷替曲塞組患者更早得到觀察,並更經常地為早期臨床進展的評估提供機會。
(二)國內臨床試驗
在國內採用多中心、隨機盲法、陽性藥物平行對照的方法,評價注射用雷替曲塞(3mg/m2)聯合奧沙利鉑(130mg/m2)(21天重複)治療局部晚期或轉移復發性結直腸癌患者的療效和安全性並與5-FU/CF(375mg/m2/200mg/m2)聯合奧沙利鉑(130mg/m2)(21天重複)治療相比較。
本試驗入組患者216例,試驗組113例。分析安全集(SS)214例,試驗組112例;FAS集和PP集均為203例,試驗組103例。
結果顯示試驗組相對照組腫瘤客觀有效率(按WHO實體瘤近期客觀療效標準CR+PR)分別為29.1%和17.0%。其中初治病例中試驗組和對照組的有效率分別為28.8%和20.8%(P=0.3368)復治病例中試驗組和對照組的有效率分別為29.4%和12.8%。
國內上述聯合用藥的臨床研究結果僅提供了該聯合方案初步臨床安全有效信息,目前尚無國內晚期結直腸癌患者單用本品的臨床研究資料,結合國外大型本品單藥臨床試驗結果考慮,可基本提示本品單藥的臨床安全性和有效性,申報單位承諾上市後進行本品單藥用於不能耐受或不適合5-Fu/亞葉酸鈣冶療的晚期結直腸癌患者的臨床研究。

藥理毒理
藥理作用:
雷替曲塞為抗代謝類葉酸類似物,特異性地抑制胸苷酸台酶(TS)。與5-FU或氨甲喋呤相比,雷替曲塞是直接的和特異性的TS抑制劑。TS是胸腺嘧啶脫氧核苷三磷酸鹽(TTP)合成過程的關鍵酶,而TTP又是DNA合成的必須核苷酸。抑制TS可導致DNA斷裂和細胞凋亡。雷替曲塞經還原葉酸載體攝入細胞被葉醯聚谷氨酸合成酶轉化成聚谷氨酸鹽形式貯存細胞中,發揮更強TS抑制作用。雷替曲塞聚谷氨酸鹽通過增強TS抑制能力、延長抑制時間而提高其抗瘤活性。但其在正常組織中的貯留可能會使霉性增加。
毒理研究:
急性毒性:小鼠和大鼠的LD50分別為>500mg/kg和875-1249mg/kg。小鼠在≥750mg/kg劑量日可導致中毒死亡。
重複給藥毒性:大鼠連續1個月及6個月間隔給藥研究發現其毒性完全與藥物的細胞毒作用有關。
主要靶器官為胃腸道、骨髓和睪丸。在犬中進行了相同的試驗研究,犬的靶器官與大鼠相同,但出現毒性反應的血漿藥物水平明顯低於預期臨床水平。劑量蓄積現象與臨床使用相似,僅誘發藥理作用相關的組織增生。此外,在犬30天重複給藥實驗中觀察到了心血管變化(心動過緩),該反應機制尚不清楚。
遺傳毒性:在細菌回復突變試驗(Ames)、E.coli或中國倉鼠卵巢細胞基因突變試驗中,雷替曲塞無誘導突變作用,在體外人淋巴細胞試驗中,雷替曲塞引起染色體受損增加,在體外的人結腸(HCT-8)癌細胞試驗中可引起單鏈DNA斷裂增加。經加入胸腺嘧啶脫氧核苷可得到改善,說明雷替曲塞為抗代謝藥物。大鼠體內微核試驗顯示雷替曲塞在細胞毒劑量水平可引起骨髓的染色體損傷。
生殖毒性:試驗顯示雷替曲塞可損害雄性大鼠生殖力,停藥3個月後恢復。雷替曲塞可引起孕鼠出現死胎和胚胎畸形。
致癌性:雷替曲塞的致癌性尚未進行評價。
雷替曲塞為抗代謝類葉酸類似物,特異性地抑制胸苷酸台酶(TS)。與5-FU或氨甲喋呤相比,雷替曲塞是直接的和特異性的TS抑制劑。TS是胸腺嘧啶脫氧核苷三磷酸鹽(TTP)合成過程的關鍵酶,而TTP又是DNA合成的必須核苷酸。抑制TS可導致DNA斷裂和細胞凋亡。雷替曲塞經還原葉酸載體攝入細胞被葉醯聚谷氨酸合成酶轉化成聚谷氨酸鹽形式貯存細胞中,發揮更強TS抑制作用。雷替曲塞聚谷氨酸鹽通過增強TS抑制能力、延長抑制時間而提高其抗瘤活性。但其在正常組織中的貯留可能會使霉性增加。
毒理研究:
急性毒性:小鼠和大鼠的LD50分別為>500mg/kg和875-1249mg/kg。小鼠在≥750mg/kg劑量日可導致中毒死亡。
重複給藥毒性:大鼠連續1個月及6個月間隔給藥研究發現其毒性完全與藥物的細胞毒作用有關。
主要靶器官為胃腸道、骨髓和睪丸。在犬中進行了相同的試驗研究,犬的靶器官與大鼠相同,但出現毒性反應的血漿藥物水平明顯低於預期臨床水平。劑量蓄積現象與臨床使用相似,僅誘發藥理作用相關的組織增生。此外,在犬30天重複給藥實驗中觀察到了心血管變化(心動過緩),該反應機制尚不清楚。
遺傳毒性:在細菌回復突變試驗(Ames)、E.coli或中國倉鼠卵巢細胞基因突變試驗中,雷替曲塞無誘導突變作用,在體外人淋巴細胞試驗中,雷替曲塞引起染色體受損增加,在體外的人結腸(HCT-8)癌細胞試驗中可引起單鏈DNA斷裂增加。經加入胸腺嘧啶脫氧核苷可得到改善,說明雷替曲塞為抗代謝藥物。大鼠體內微核試驗顯示雷替曲塞在細胞毒劑量水平可引起骨髓的染色體損傷。
生殖毒性:試驗顯示雷替曲塞可損害雄性大鼠生殖力,停藥3個月後恢復。雷替曲塞可引起孕鼠出現死胎和胚胎畸形。
致癌性:雷替曲塞的致癌性尚未進行評價。
藥代動力學
國外臨床研究資料顯示,患者注射3mg/m2霄替曲塞,藥物濃度與時間呈三室模型。注射結束時濃度達最高峰,然後迅速下降,之後進入慢消除相。靜脈注射3mg/m2雷替曲塞主要藥代動力學參數如下,根據27名腫瘤患者靜脈輸注雷替曲塞15分鐘進行計算:
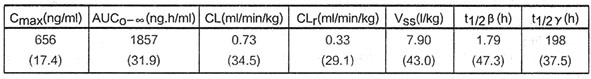
CL、CLr和Vss均為按實際體重校正後的結果。
表解:Cmax:血藥濃度峰值
AUC:血藥濃度-時間曲線下面積
CL:清除率
CLr:腎清除率(n=9)
Vss:穩態分布容積
t1/2β:第二相半衰期
t1/2γ:消除半衰期
表中括弧內數據為變異係數(CV%)。
最初分布相(α)的t1/2α約為10分鐘,反映雷替曲塞在體內的分布變化非常迅速,由於時間短,這項測定結果的可靠性不如t1/2β和t1/2γ,消除相半衰期t1/2γ也即最長半衰期代表了藥物從體內清除的速率。
雖然患者間存在一些差異,雷替曲塞的平均最大濃度在1.6~3mg/m2劑量範圍內成比例地增加。
在臨床劑量範圍內雷替曲塞的C max與用藥劑量呈線性關係。腎功能正常者3周間期連續用藥血漿中無明顯藥物蓄積。除在細胞內被聚谷氨酸化外,雷替曲塞不被代謝,主要以原形經尿排出(400%—50%)。10天約15%雷替曲塞經糞便排泄。觀察期間碳-14標識的雷督曲塞約一半沒有回收到,即部分(以聚谷氨酸鹽的形式)貯留於組織中。29天紅血球中檢測到微量放射標記。
性別、年齡對雷替曲塞藥代動力學參數無影響,兒童藥代動力學尚無研究。初步研究顯示肝損傷患者用藥雷替曲塞的清除率降低,但降低程度尚未明確。輕到中度的肝功能不全患者血漿清除率下降低於25%。輕到中度的腎功能不全(Cr:25~65mI/min)者血漿清除率明顯下降(約50%)。
貯藏
密閉,在涼暗處(避光且不超過20℃)保存。
包裝
玻璃管制注射劑瓶裝,1瓶/盒盒25瓶/盒。
有效期
24個月。
執行標準
YBH08252009
