物性數據
1、性狀:無色固體;
2、熔點(℃):110;
3、溶解性:溶於THF和乙醚溶劑。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:0
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:0
7、重原子數量:1
8、表面電荷:0
9、複雜度:0
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:1
性質與穩定性
1、氫化鋁為無色的固體。對熱不穩定,加熱到150~200℃時即分解。準確的分解溫度因AlH3的生成條件而異。氫化鋁為強還原劑。遇水或濕氣會發生爆炸反應而生成氫氣。光照後即分解。在-10℃的封閉管中能夠保存一年。極易溶於四氫呋喃中。在乙醚中的溶解度為0.2mol/L。在乙醚中合成的產物是由AlH3和乙醚按摩爾比0.29~0.33構成的加成物。不含乙醚的產物是把AlH3的乙醚溶液加入到特別過量的戊烷或己烷中所得到的白色沉澱。一旦從乙醚中沉澱出來就不會再溶於乙醚中。如果有強的路易斯鹼L存在,則生成LAlH3或者L2AlH3而溶解。
2、氫化鋁溶液不會自燃,但與水、酸類、潮濕空氣接觸有引起燃燒危險,遇氧化劑反應劇烈。氫化鋁溶液必須原位製備使用,大約3天后就會降解,因此不可能長時間保存。使用是必須小心謹慎。
合成方法
1、原料的提純:以下的所有操作必須在充滿氮氣或氬氣的乾燥箱中進行。不得含有水蒸氣,含氧量不超過3~4mL/m。而且,必須在系統中除去能與反應物和生成物進行反應的物質。當存在少量雜質時就可能把生成的氫化鋁分解掉。所有的試劑必須全用無水的。市售的乙醚、氫化鋁鋰、三氯化鋁等都必須進一步提純。使用的玻璃器具要用濃硝酸、王水或者重鉻酸鹽洗過之後,再用蒸餾水沖洗幾次,在110~120℃下進行乾燥。將氫化鋁鋰加到乙醚內,在氮氣中或真空中蒸餾,並通過裝有分子篩的柱(40cm)進行乾燥、提純。因為乙醚非常容易揮發,這些操作應在通風櫥內進行。將氫化鋁鋰溶於乙醚,過濾後經減壓蒸餾蒸出溶劑濃縮,進行重結晶。三氯化鋁可在高真空下使其升華(110~120℃)得以提純,在此溫度下要使50g三氯化鋁升華需要24h,其蒸氣再通過1~2cm長的裝有活性炭(50~200目)吸附柱處理,可更加純淨。
2、合成:主反應3LiAlH4+AlCl3→4AlH3+3LiCl
在乾燥箱中,把32.3g三氯化鋁(0.242mol)和電磁攪拌棒裝入500mL圓底燒瓶中,加塞後將燒瓶從乾燥箱中取出,在低氮氣壓下(25~50mmHg,1mmHg=133.322Pa)迅速安裝盛有乙醚的滴液漏斗,將上述500mL燒瓶放在乾冰二氯甲烷浴中一邊攪拌物料一邊進行冷卻,從滴液漏斗把經過蒸餾提純的300mL乙醚慢慢地加入燒瓶中。乙醚冷卻後從乾冰浴中取出燒瓶。如果三氯化鋁發生放熱的溶劑化反應而使乙醚沸騰時,應把燒瓶再次冷卻。三氯化鋁溶解後,將溶液加熱到室溫,嚴密加塞放入乾燥箱。另取28.2g純氫化鋁鋰(0.743mol)裝入容積為1.5L的燒瓶中,並用750mL蒸餾過的乙醚加以溶解。然後往LiAlH4和AlCl3的乙醚溶液表面分別吹入乾燥氮氣,使其冷卻到-5℃。為了保持一定的溶劑體積必須經常加入乙醚。將AlCl3溶液在攪拌下加到冷的LiAlH4溶液中。加完後,對反應混合液施以19.7~34.2kPa壓力的氮氣,經玻璃過濾器,濾到1.5L燒瓶中。該燒瓶預先裝入10g NaBH4(該NaBH4應在真空中於60℃乾燥8h,並粉碎至1μm以下,可得最好的結果)和電磁攪拌棒。攪拌濾液,利用NaBH4將未反應的AlCl3從AlH3的乙醚溶液中除去。LiBlH4留在溶液中,氯化鈉則沉澱出來。邊往濾液中吹入乾燥氮氣邊攪拌3~4min之後,再往另一個1.5L燒瓶中過濾。這樣就可把過剩的NaBH4和已沉澱的氯化鈉除去。往濾液中邊吹入乾燥氮氣,邊濃縮至600mL之後,加熱到室溫。經6~8h後,氫化鋁的乙醚加成物就沉澱出來。將生成物過濾後,用100mL無水乙醚洗滌兩次,在高真空下乾燥10~12h;產量約30g(58%)。
貯存方法
在氮氣中貯存。
用途
氫化鋁是一種對多種官能團有效的還原試劑,能夠將醛、縮醛、酮、醌、縮酸、酸酐、醯氯、酯和內酯還原為相應的醇,將醯胺、腈、肟和異氰酸酯還原為相應的胺。氫化鋁對硝基化合物、硫化物、碸以及甲基苯磺酸鹽無還原活性,但是對二硫化物和亞碸有效。
對於酮的還原,氫化鋁較其它還原試劑能夠表現出不同的立體選擇性,這點在具有生物活性的甾族化合物的還原中尤為重要 (式1)。對於α,β-不飽和酮還原為烯丙醇的反應,氫化鋁也能表現出特異的立體選擇性 (式2)。
對於羧酸和酯的還原反應,氫化鋁較氫化鋁鋰的反應更快。但是對於鹵代烷烴的還原,氫化鋁則表現出較惰性的還原活性。因此使用氫化鋁可以有效地實現帶鹵素的羧酸和酯的還原反應 (式3)。此外,氫化鋁鋰能夠還原硝基化合物,而氫化鋁則對其不具有還原效果,因此使用氫化鋁還能實現帶硝基的羧酸和酯的還原反應 (式4)。
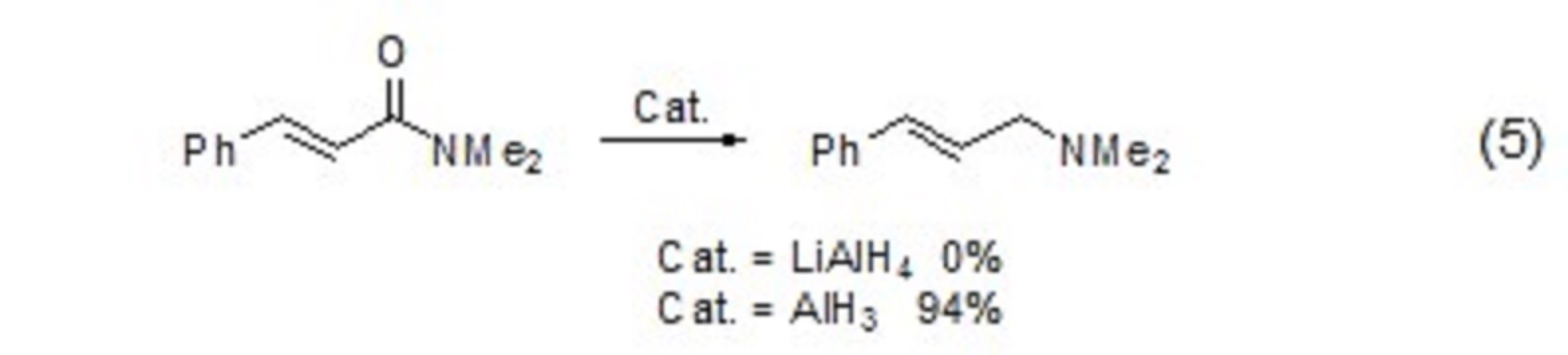
對於醯胺化合物還原為胺的反應,通常存在C-O鍵斷裂和C-N鍵斷裂的競爭反應。但使用氫化鋁則可以選擇性地實現C-O鍵的斷裂,從而實現α,β-不飽和醯胺向烯丙基胺化合物的轉化 (式5)。
由於氫化鋁的鹼性相對氫化鋁鋰較弱,因此對於含酸性氫原子的底物同樣適用。如對含有酸性α-H的烯丙基腈化合物的還原 (式6,式7)。
氫化鋁的另一類重要反應是誘導環氧化合物的開環反應。對於大多數環氧化合物,負氫進攻都是發生在立體位阻較小的一端 (式8)[5],但由於氫化鋁中負氫自身的性質,它也可以進攻立體位阻較大的碳原子 (式9)。
此外,氫化鋁還能實現丙炔醇系統上的氫鋁化反應,即對炔烴發生加成反應,進而用碘淬滅實現sp2-碘代烯丙醇化合物的製備。並且氫化鋁較氫化鋁鋰表現出了不同的區域選擇性,負氫會優先進攻3-位炔碳原子 (式10)。