基本介紹
- 中文名:氨氣製法
- 外文名:Ammonia process
- 目的:製取氨氣
- 類型:實驗方法
- 分類:濃氨水與鹼混合及工業製法
氨氣概述,理化性質,重要性,實驗室製法,固體銨鹽製取,氮化物製取,濃氨水製取,工業合成氨技術,造氣,脫硫,變換,精煉,合成,其他方法,用途與貯運,
氨氣概述
理化性質
氨氣,Ammonia, NH3,無色氣體。有強烈的刺激氣味。密度 0.7710。相對密度0.5971(空氣=1.00)。易被液化成無色的液體。在常溫下加壓即可使其液化(臨界溫度132.4℃,臨界壓力11.2兆帕,即112.2大氣壓)。沸點-33.5℃。也易被固化成雪狀固體。熔點-77.75℃。溶於水、乙醇和乙醚。在高溫時會分解成氮氣和氫氣,有還原作用。有催化劑存在時可被氧化成一氧化氮。用於制液氮、氨水、硝酸、銨鹽和胺類等。可由氮和氫直接合成而製得,能灼傷皮膚、眼睛、呼吸器官的黏膜,人吸入過多,能引起肺腫脹,以至死亡。
重要性
氨作為化工產品的重要組成部分,也是化肥的最主要原料之一,在我國的消耗使用量巨大。氨的生產對農業的發展具有十分重要的作用,據統計,化肥對世界糧食增產有超過40%的貢獻率。近百年來,世界人口增加了4.5 倍,而口糧的產量卻增加了7.7 倍。現在全球氮肥產量約1.2 億噸,世界人均消耗氮肥20kg,合成氨工業為人體提供了50%的氮元素。可以這樣說,如果沒有合成氨技術,世界上將有近一半的人無法存活。
現階段(2019年),每年有3億噸的大氣中的N2通過活化作用被固定,但通過反硝化作用返回到大氣中的 N2只有1億噸。其他活化的氮素以氮氧化物形式返回大氣中會造成空氣污染和溫室效應,若以NO3-的形式進入地表水體會造成富營養化和近海赤潮。減少合成氨工業負面影響並發揮其正面作用對保護生態環境具有十分重要的意義。
實驗室製法
固體銨鹽製取
加熱固體銨鹽和鹼的混合物
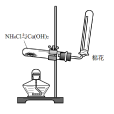
反應原理:2NH4Cl+Ca(OH)2= CaCl2+2NH3↑+2H2O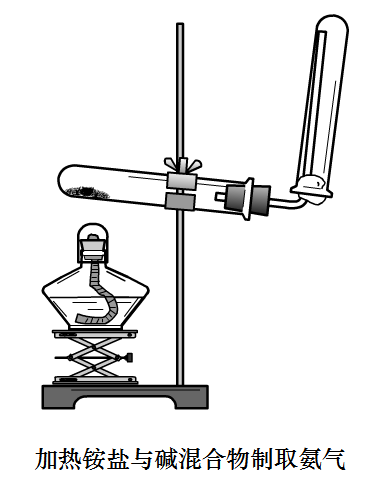 裝置圖1
裝置圖1
 裝置圖1
裝置圖1淨化裝置(可省略):用鹼石灰乾燥。
尾氣裝置:收集時,一般在管口塞一團棉花球,可減少NH3與空氣的對流速度,收集到純淨的NH3。
注意事項:
- 用試管收集氨氣要堵棉花。因為NH3分子微粒直徑小,易與空氣發生對流,堵棉花目的是防止NH3與空氣對流,確保收集純淨;減少NH3對空氣的污染。
氮化物製取
可以用氮化物與水反應或者疊氮化物分解。如:
- Li3N + 3H2O = 3LiOH + NH3↑
濃氨水製取
反應原理:NH3·H2O =△= NH3↑+H2O。 裝置圖2
裝置圖2
 裝置圖2
裝置圖2這種方法一般用於實驗室快速制氨氣。
注意事項:加熱濃氨水時也會有水蒸氣,需要用乾燥裝置除雜。同上,這種方法制NH3除水蒸氣用鹼石灰,而不要採用濃H2SO4和固體CaCl 。
濃氨水中加固態鹼性物質
反應原理:濃氨水中存在以下平衡:
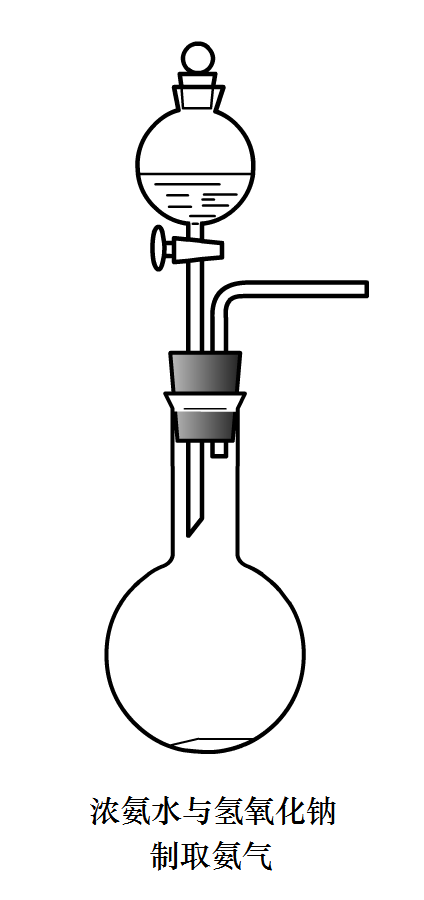 裝置圖3
裝置圖3加入固態鹼性物質(如CaO,NaOH,鹼石灰等),消耗水且使c(OH-)增大,使平衡移動,同時反應放熱,促使NH3·H2O的分解。
工業合成氨技術
合成氨指由氫氣、氮氣在高壓、高溫、催化劑作用下直接化合生成的氨,是固氮的一種方法。目前世界上的氨,除少數從焦爐氣中回收的副產品外,絕大部分均由合成法製造。該法生產工藝基本過程如下:
造氣
合成氨原料氣中的氮氣一般來自空氣,氫氣則需要製備。制氫的原料有天然氣、石腦油、重質油、煤等。
脫硫
制氫的原料中,一般含有少量的硫化氫或硫化物,它們會進入原料氣中,這些含硫物質,極易使後續階段使用的催化劑中毒,必須首先將其除去,這個過程稱為脫硫。脫硫主要有物理吸收(用甲醇、聚乙二醇二甲醚作吸收劑)和化學吸收兩種,後者常用的有氨水催化法和改良蒽醌二磺酸法等。
變換
經脫硫後的原料氣中,除氫氣外,還含有一定量的一氧化碳。為提高氫氣產量,利用水蒸氣和一氧化碳反應,使之轉化成氫氣,該過程稱為變換。反應式如下:
CO+H2O→CO2+H2
反應必須通過使用催化劑完成。
脫碳。將變換氣中的二氧化碳除去的過程叫脫碳。其方法有物理吸收和化學吸收兩種,後者效果更好。我國開發的氨水脫除二氧化碳得到碳酸氫銨(一種常用氮肥)的方法在小型合成氨廠普遍使用。其反應式如下:
NH3+CO2+H2O→NH4HCO3
精煉
經過上述幾個過程得到的氮、氫原料氣中還含有少量的一氧化碳和二氧化碳,而合成反應使用的催化劑要求碳的氧化物總量不能大於10ppm,必須進一步脫去;少量水分對催化劑的活性等也有影響, 同樣要除去。除去這些微量有害物質的過程, 稱為精煉。最早採用銅氨液吸收法,反應式為:
Cu(NH3)2+CO+NH3→Cu(NH3)3CO
少量二氧化碳可被氨進一步吸收。反應式為:
CO2+H2O+NH3→NH4HCO3
60年代後新開發的鎳作催化劑, 使二氧化碳、一氧化碳與氫反應生成甲烷的精煉工藝效果更好。反應式如下:
CO+3H2→H4+H2O
CO2+4H2→CH4+2H2O
以天然氣為原料的合成氨廠一般採用此工藝。
近年來,工業上新開發的分子篩吸附法,對少量水蒸氣、微量二氧化碳的清除效果很好, 通過加熱, 分子篩仍可再生復用。
合成
經過上述處理並經過多級壓縮後達到指定高壓 (一般為32MPa) 的氮、氫混合氣, 送到合成塔中在一定溫度 (~500℃)範圍內,經催化劑(Fe2O3為主體)作用,進行合成反應。反應式如下:
3H2+N2→2NH3
必須指出, 這個過程只有少部分反應氣轉化成氨, 大部分仍將循環使用。
其他方法
- 天然氣制氨。天然氣先經脫硫,然後通過二次轉化,再分別經過一氧化碳變換、二氧化碳脫除等工序,得到的氮氫混合氣,其中尚含有一氧化碳和二氧化碳約0.1%~0.3%(體積),經甲烷化作用除去後,製得氫氮摩爾比為3的純淨氣,經壓縮機壓縮而進入氨合成迴路,製得產品氨。以石腦油為原料的合成氨生產流程與此流程相似。
- 重質油制氨。重質油包括各種深度加工所得的渣油,可用部分氧化法製得合成氨原料氣,生產過程比天然氣蒸氣轉化法簡單,但需要有空氣分離裝置。空氣分離裝置製得的氧用於重質油氣化,氮作為氨合成原料外,液態氮還用作脫除一氧化碳、甲烷及氬的洗滌劑。
- 煤(焦炭)制氨。隨著石油化工和天然氣化工的發展,以煤(焦炭)為原料製取氨的方式在世界上已很少採用。
用途與貯運
用途: 氨主要用於製造氮肥和複合肥料,氨作為工業原料和氨化飼料,用量約占世界產量的12%。硝酸、各種含氮的無機鹽及有機中間體、磺胺藥、聚氨酯、聚醯胺纖維和丁腈橡膠等都需直接以氨為原料。液氨常用作製冷劑。
貯運: 商品氨中有一部分是以液態由製造廠運往外地。此外,為保證製造廠內合成氨和氨加工車間之間的供需平衡,防止因短期事故而停產,需設定液氨庫。液氨庫根據容量大小不同,有不冷凍、半冷凍和全冷凍三種類型。液氨的運輸方式有海運、駁船運、管道運、槽車運、卡車運。