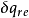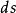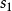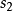熵是工程熱力學中的一個狀態參數。熵的變化表征了可逆過程中熱交換的方向和大小。熵的變化只與其始末狀態有關,與達到這一狀態的過程無關。當系統的熵增大時,系統從外界吸熱。當系統的熵減小時,系統對外界放熱。而1kg工質的熵,便是比熵。
基本介紹
- 中文名:比熵
- 外文名:specific entropy
- 學科:工程熱力學
- 定義:單位質量工質的熵
卡諾定理,熵的基本概念,比熵的基本概念,
卡諾定理
1824年法國工程師卡諾在熱機效率進行深入研究的基礎上,提出了著名的卡諾定理。其表述如下:
定理一:在相同的高溫熱源和低溫熱源間工作的一切可逆熱機具有相同的熱效率,與工質的性質及循環形式無關。
定理二:在相同的高溫熱源和低溫熱源間工作的一切不可逆熱機的熱效率,都小於可逆熱機的熱效率。
熵的基本概念
根據卡諾定理,在溫度分別為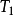 和
和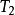 的恆溫熱源間工作的一切可逆熱機的熱效率都相同,即
的恆溫熱源間工作的一切可逆熱機的熱效率都相同,即
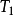
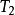
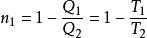
即
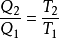
式中, 、
、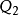 均為絕對值,如果改為代數值,
均為絕對值,如果改為代數值,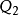 應為負值,於是上式可寫為:
應為負值,於是上式可寫為:

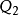
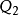
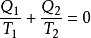
說明,在卡諾循環中,工質與熱源交換的熱量除以熱源的熱力學溫度所得的商的代數和等於零。
可以證明,以上結論適用於任何可逆循環。圖1示出的是一個任意可逆循環,假設用一組可逆絕熱線將其分割成無數個微元循環。對於每個微元循環(如圖a-b-c-d-a)可認為是由兩個可逆定溫過程和兩個可逆絕熱過程組成的微元卡諾循環,根據上面分析的所得式,則有:
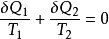
對全部微元卡諾循環積分,可得
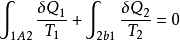
式中 、
、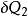 ——代表微元循環與熱源交換的熱量,本身為代數值,由於含義相同,可統一用
——代表微元循環與熱源交換的熱量,本身為代數值,由於含義相同,可統一用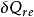 表示;
表示;

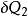
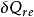
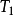
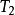

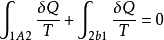
即
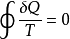
稱為克勞休斯積分等式。它表明,工質經任意可逆循環後,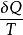 沿整個循環的積分為零。
沿整個循環的積分為零。
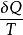
由上式可知,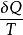 具有狀態參數的特性,因此,
具有狀態參數的特性,因此,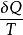 必定是一狀態參數。1865年克勞休斯將這一狀態參數定名為熵,以符號S表示,單位為J/K,於是
必定是一狀態參數。1865年克勞休斯將這一狀態參數定名為熵,以符號S表示,單位為J/K,於是
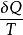
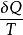
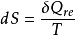
對於1kg的工質,式可寫成
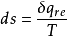
式中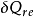 、
、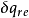 ——下標是強調
——下標是強調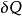 或
或 必須是可逆過程的換熱量;
必須是可逆過程的換熱量;
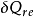
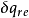
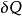


 圖1
圖1比熵的基本概念
1kg工質的熵便成為比熵。熵參數可以從熱力學理論的數學分析中導出,正如狀態參數焓,熵也是用數學式給予定義的,對於1kg工質的熵變,可以用下式表示:
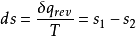
式中: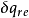 為1kg工質在微元可逆過程中與熱源交換的熱量;
為1kg工質在微元可逆過程中與熱源交換的熱量; 是傳熱時工質的熱力學溫度;
是傳熱時工質的熱力學溫度;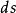 是微元過程中1kg工質的熵變,稱為比熵變。而
是微元過程中1kg工質的熵變,稱為比熵變。而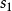 、
、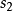 為不同狀態下1kg工質的熵,稱為比熵。
為不同狀態下1kg工質的熵,稱為比熵。