專利背景
坦度螺酮屬螺酮類藥物,為5-HT受體激動劑,它高度選擇與5-HT1A受體結合。5-HT1A受體主要集中在海馬、中隔、腳間核、杏仁核等大腦邊緣系統以及縫腺核中。坦度螺酮選擇性激動突觸後膜的5-HT。抑制亢進的5-羥色胺能神經活動,使5-HT與突觸後膜的5-HT1A和5-HT2A受體的結合恢復平衡狀態,從而發揮抗焦慮作用,不產生苯二氮卓類抗焦慮藥物的肌肉鬆弛、抗驚厥等副反應。臨床前試驗數據表明,坦度螺酮的抗焦慮作用與地西泮相近,而神經運動性功能損害以及藥物濫用等毒副作用比地西泮小。坦度螺酮還具有一定的抗抑鬱作用,因此對於混合有焦慮和抑鬱的病人可以發揮更好的作用。臨床前研究顯示,坦度螺酮比其原形藥物氮雜螺酮以及丁螺環酮的抗焦慮作用選擇性更高,臨床套用前景較好。在一項研究中有202例病人(分別具有焦慮或抑鬱的精神症狀)接受了不同劑量坦度螺酮(7.5毫克/天、15毫克/天、30毫克/天和60毫克/天)的治療,持續4周。4個劑量組病人出現中度或顯著的全面改善,比率依次為29%、19%、33%和46%,此外30毫克/天和60毫克/天兩組病人接受治療後。有45.8%的病人各種精神症狀出現中度或顯著改善。病人接受坦度螺酮30毫克/天或60毫克/天的抗焦慮效果是令人滿意的。
坦度螺酮(包括枸櫞酸坦度螺酮)的安全性比較好,不良反應發生率低,程度輕。在1451例病人中有150例(10.3%)出現不良反應。主要的不良反應有嗜睡43例(3.0%)、步態蹣跚16例(1.1%)、噁心13例(0.9%)、倦怠感11例(0.8%)、情緒不佳11例(0.8%)、食慾下降10例(0.7%)。造成上述不良反應的原因2008年7月尚無相關文獻報導,因此,為了保護坦度螺酮的安全性,嚴格控制枸櫞酸坦度螺酮的質量十分必要。
坦度螺酮的合成方法見US4507303,US4818756,JP60087262等均有報導。但其合成方法與本專利相比,其生產成本高,收率低,不利於大規模生產。
2008年7月尚無用順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺與季胺鹽進行縮合製備坦度螺酮的合成方法,也沒有使用馬來酸亞胺與環戊二烯反應再氫化製成順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的合成方法,也無使用高純度順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺製備高純度坦度螺酮的報導,更無採用HPLC法對順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺中的未轉型順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺和未還原順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的分析與質量控制的報導,也無坦度螺酮的合成工藝中關於雜質的成分、結構及性質的相關報導,也沒有具體哪種雜質對坦度螺酮的藥效、安全性影響的相關報導。
發明內容
專利目的
《枸櫞酸坦度螺酮及其製備方法、製劑和質量控制方法》的技術方案是提供了一種枸櫞酸坦度螺酮,該發明還提供了枸櫞酸坦度螺酮的製備方法和質量控制方法。
技術方案
《枸櫞酸坦度螺酮及其製備方法、製劑和質量控制方法》提供了一種枸櫞酸坦度螺酮,它含有化合物I的重量百分含量不得高於0.5%,含有化合物II的重量百分含量不得高於0.5%,化合物I、II的結構式為:

化合物II為坦度螺酮的對映異構體,化學名為(3eα,4β,7β,7eα)-六氫-2-[4-(2-嘧啶基)-1-(哌啶基)-丁基]-4,7-亞甲基-1H-異吲哚-1,3(2H)-二酮枸櫞酸鹽。
進一步優選地,它含有化合物I的重量百分含量為:0%-0.3%,含有化合物II的重量百分含量為:0%-0.3%。
進一步優選地,它含有化合物I的重量百分含量為:0-0.1%,含有化合物II的重量百分含量為:0-0.1%。
可進一步優選地,它含有化合物I的重量百分含量為:0.04-0.31%,含有化合物II的重量百分含量為:0.05-0.29%。
該發明所述的枸櫞酸坦度螺酮,它的HPLC色譜如圖1所示,由至少一個特徵峰,該特徵峰的出峰時間為:9.513-9.857分鐘,高效液相色譜法的色譜條件為:用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升
磷酸二氫鉀溶液-乙腈(60±5:40±5)為流動相;檢測波長為243納米,理論板數按坦度螺酮峰計算應不低於5000。
進一步地,HPLC色譜圖還含有兩個特徵峰,出峰分別條件為:6.342-6.608分鐘,7.835-8.082分鐘。但在具體的檢測過程中,因所用的設備、操作人員、環境的不同,其出峰時間可能會出現提前或推遲1分鐘左右的情況。
該發明還提供了一種抗焦慮的藥物組合物,它是由所述的有效量的枸櫞酸坦度螺酮為活性成分,加入藥學上可接受的輔料或輔助性成分製備而成的藥劑。
其中,所述的藥劑為口服製劑。所述的口服製劑為片劑、膠囊劑或顆粒劑等。
該發明還提供了製備所述的枸櫞酸坦度螺酮的方法,它包括如下步驟:

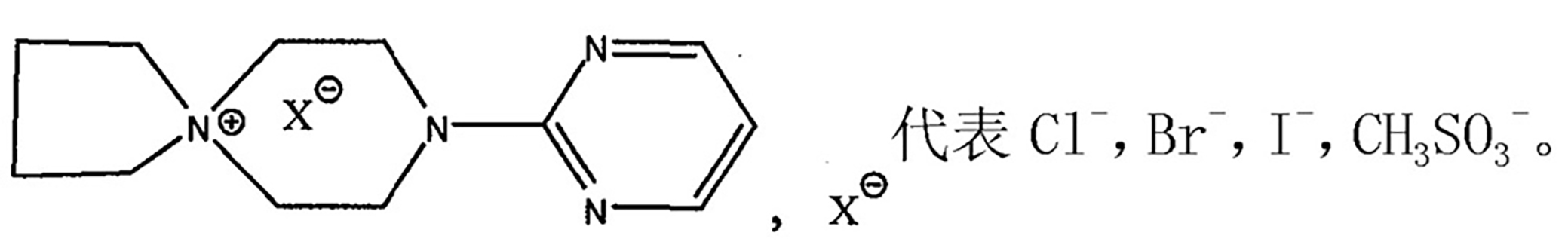
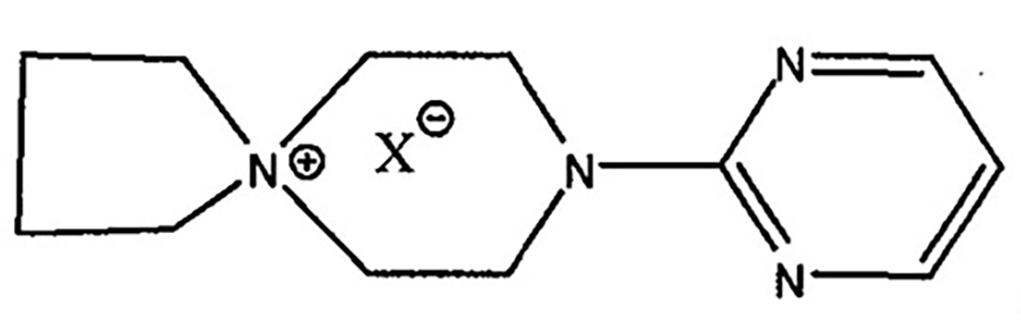
該化合物簡稱季銨鹽
其中x代表Cl、Br、I、CH3SO3。
將順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺、季胺鹽摩爾比為1:1、N,N-二甲基甲醯胺、無水碳酸鉀加入到反應器中,保溫113-157℃攪拌反應5-10小時。反應完畢,反應液冷卻至室溫攪拌下緩慢加入水中,再充分攪拌,靜置,抽濾,濾餅用水充分洗滌;將濾餅用乙酸乙酯溶解,加入鹽酸溶液酸化,至pH2-3,分出酸液,於酸液中加活性炭適量,充分攪拌,冷脫色,過濾;濾液用氫氧化鈉溶液調pH值至10-11,產生類白色沉澱,攪拌,靜置,抽濾,濾液回收,濾餅用飲用水洗滌,抽乾,得坦度螺酮鹼,經枸櫞酸成鹽,得到枸櫞酸坦度螺酮;其中,所述的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺純度不得小於99.0%。
順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺與特定的季胺鹽類縮合得坦度螺酮鹼,在無水乙醇溶液中與枸櫞酸成鹽得枸櫞酸坦度螺酮粗品,用無水乙醇進行重結晶得成品。
順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺也可由下面兩種方法獲得:
A、

由降冰片烯二酸酐在190-210℃轉型得轉型物,轉型物在鈀碳為催化劑的條件下氫化得氫化物,氫化物經氨水氨化製得順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺。
B、

將馬來醯亞胺與環戊二烯反應,通過結晶法得所需具有專一構型的物品,再經氫化即得製備坦度螺酮鹼的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺。
在嚴格控制順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度下,可以製備成符合該發明要求的枸櫞酸坦度螺酮。
該發明提供的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度控制方法為:純度照《高效液相色譜法操作規程》測定。
色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液(用10%氫氧化鈉溶液調節pH至7.5)-乙腈(80:20)為流動相;檢測波長為243納米。理論板數按順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺峰計算應不低於1500。
測定法取本品約0.1克,置10毫升量瓶中,加流動相溶解,並稀釋至刻度,搖勻,作為供試品溶液;精密量取供試品溶液各20微升,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。
按面積歸一化法計算,RRT=0.43的雜質不得大於0.5%;RRT=0.65的雜質(未轉型未還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺)不得大於0.1%;RRT=0.78的雜質(未轉型已還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺)不得大於0.30%;RRT=0.87(轉型未還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺)的雜質不得大於0.4%;順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺純度不得小於99.0%。
該發明還提供了一種控制所述的枸櫞酸坦度螺酮的方法,它是以化合物I、化合物II為指標成分,進行質量控制。
該發明所述的質量控制方法,它是照高效液相色譜法測定,色譜條件為:用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液-乙腈(體積比為60±5:40±5)為流動相;檢測波長為243納米,理論板數按坦度螺酮峰計算應不低於5000。
改善效果
該發明發明人在生產過程中對枸櫞酸坦度螺酮的有關物質進行了研究,發現有關物質中一雜質為合成工藝中中間體未轉型已還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺而產生的雜質,是枸櫞酸坦度螺酮的一個異構體,命名為異構體B(化合物II)。在合成工藝中始終存在,只有在順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺質量中嚴格控制未轉型已還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺限度,雜質異構體B是可以控制到最低。而另一雜質(本雜質為合成工藝中中間體既未能轉型,又未能被還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺而產生的雜質,命名為雜質A(化合物I)同樣為合成工藝中產生的雜質,其含量很低,只有在順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺質量標準中嚴格控制未轉型未還原的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺限度,才能控制雜質A(化合物I)。通過試驗,發現異構體B與雜質A是合成本品過程中必定產生的雜質,且能影響枸櫞酸坦度螺酮的藥效及副作用,而原質量標準中只對雜質總量進行了限制,並沒有具體定量限制哪一種雜質的量。為更好的控制枸櫞酸坦度螺酮的質量,發明人並對雜質異構體B及雜質A進行了確認和限量研究,根據多批大生產樣品確定了雜質異構體B及雜質A的限量。結果表明,枸櫞酸坦度螺酮在提高質量標準後,臨床抗焦慮的效果有顯著提高,而不良反應卻有明顯的降低。
附圖說明
圖1枸櫞酸坦度螺酮(批號060101)色譜圖;
圖2枸櫞酸坦度螺酮(批號060101)自身對照色譜圖(測定方法中的對照溶液及為自身對照);
圖3枸櫞酸坦度螺酮(批號060102)色譜圖;
圖4枸櫞酸坦度螺酮(批號060102)自身對照色譜圖;
圖5枸櫞酸坦度螺酮(批號060103)色譜圖;
圖6枸櫞酸坦度螺酮(批號060103)自身對照色譜圖;
圖7枸櫞酸坦度螺酮(批號060401)色譜圖;
圖8枸櫞酸坦度螺酮(批號060401)自身對照色譜圖;
圖9枸櫞酸坦度螺酮(批號060402)色譜圖;
圖10枸櫞酸坦度螺酮(批號060402)自身對照色譜圖。
圖11順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺(批號060101)純度色譜圖;
圖12順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺(批號060102)純度色譜圖;
圖13順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺(批號060103)純度色譜圖;
圖14順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺(批號060104)純度色譜圖。
權利要求
1、枸櫞酸坦度螺酮,其特徵在於:含有化合物I的重量百分含量不得高於0.5%,含有化合物II的重量百分含量不得高於0.5%,化合物I、II的結構式為:
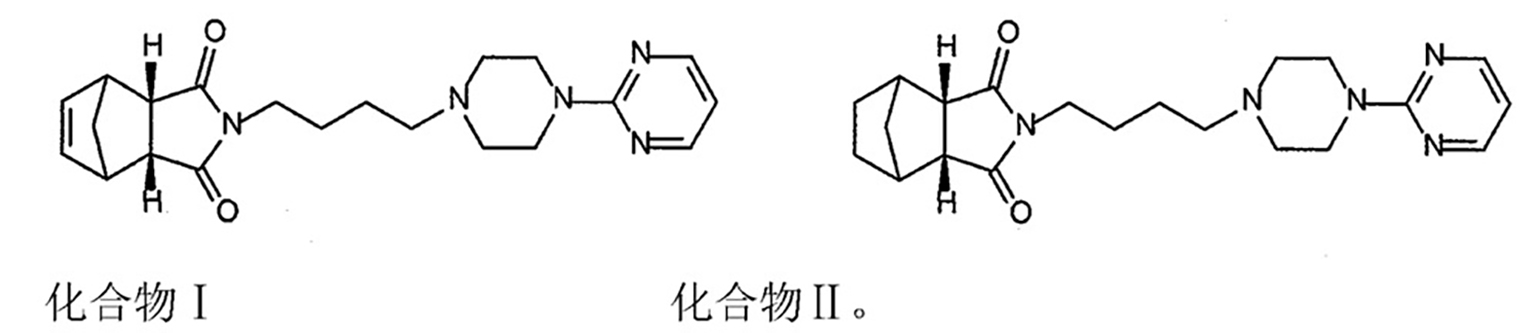
2、根據權利要求1所述的枸櫞酸坦度螺酮,其特徵在於:含有化合物I的重量百分含量為:0%-0.31%,含有化合物II的重量百分含量為:0%-0.3%。
3、根據權利要求1所述的枸櫞酸坦度螺酮,其特徵在於:含有化合物I的重量百分含量為:0.04-0.31%,含有化合物II的重量百分含量為:0.05-0.29%。
4、根據權利要求1-3任一項所述的枸櫞酸坦度螺酮,其特徵在於:它的HPLC色譜如圖1所示:
高效液相色譜法的色譜條件為:用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液-乙腈,體積比為(60±5):(40±5)為流動相;檢測波長為243納米,理論板數按坦度螺酮峰計算應不低於5000。
5、一種抗焦慮的藥物組合物,它是由權利要求1-5任一項所述的有效量的枸櫞酸坦度螺酮為活性成分,加入藥學上可接受的輔料或輔助性成分製備而成的藥劑。
6、根據權利要求5所述的抗焦慮的藥物組合物,其特徵在於:所述的藥劑為口服製劑。
7、一種製備權利要求1-4任一項所述組合物的製備方法,包括如下步驟:將順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺、季胺鹽、N,N-二甲基甲醯胺、無水碳酸鉀加入到反應器中,保溫113-157℃攪拌反應5-10小時;反應完畢,反應液冷卻至室溫攪拌下緩慢加入水中,再充分攪拌,靜置,抽濾,濾餅用水充分洗滌;將濾餅用
乙酸乙酯溶解,加入鹽酸溶液酸化,至pH2-3,分出酸液,於酸液中加活性炭適量,充分攪拌,冷脫色,過濾;濾液用
氫氧化鈉溶液調pH值至10-11,產生類白色沉澱,攪拌,靜置,抽濾,濾液回收,濾餅用飲用水洗滌,抽乾,得坦度螺酮鹼,經枸櫞酸成鹽,得到枸櫞酸坦度螺酮;其中,所述的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度不得小於99.0%;其中,所述的季銨鹽為
8、根據權利要求7所述的枸櫞酸坦度螺酮的方法,其特徵在於:其中順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺由以下兩種方法實現:
A、由降冰片烯二酸酐在190-210℃下轉型,轉型物在有鈀碳催化劑的情況下氫化為氫化物,氫化物在氨水環境下氨化為順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺;
B、由馬來醯亞胺與環戊二烯反應所得物,再經氫化即得順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺,具體步驟為:
將馬來醯亞胺加入反應瓶中,加入乙酸乙酯,攪拌使其溶解,加入環戊二烯,其中環戊二烯與馬來醯亞胺的重量配比為:1:1-2,攪拌,減壓蒸去75%溶劑,過濾,用乙醚洗滌濾餅,得特定構型物;將特定構型物溶於THF中,加入環已烯和5%鈀炭,在壓力大於0.01兆帕情況下通入氫氣,反應物回流9h,冷卻後,減壓蒸去溶劑,殘留物用甲苯重結晶得順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺。
9、一種控制權利要求1所述的枸櫞酸坦度螺酮質量的方法,它是以化合物I、化合物II為指標成分,進行質量控制,它是照高效液相色譜法測定,色譜條件為:用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液-乙腈,體積比:60±5:40±5為流動相;檢測波長為243納米,理論板數按坦度螺酮峰計算應不低於5000。
實施方式
實施案例
實施例1
該發明順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的製備
由降冰片烯二酸酐在190-210℃轉型得轉型物,轉型物在鈀碳為催化劑的條件下氫化得氫化物,氫化物經氨水氨化製得順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺。
實施例2
該發明順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的另一種製備方案
將97克馬來醯亞胺加入反應瓶中,加入1000毫升乙酸乙酯,攪拌使其溶解,加入93克環戊二烯,攪拌24小時,減壓蒸去75%溶劑,過濾,用適量的乙醚洗滌濾餅,得特定構型物163克,收率約86%。將特定構型物163克溶於2500毫升THF中,加入163克環已烯和5克的5%鈀炭,在壓力大於0.01兆帕情況下通入氫氣,反應物回流9h,冷卻後,減壓蒸去溶劑,殘留物用甲苯重結晶得產品161克,收率約98%。由此法製得的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度符合本專利所述的高純度順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的質量要求。
實施例3
該發明順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的質量控制方法:將實施例1、2製備的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺進行質量測定。
順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺純度測定照《高效液相色譜法操作規程》測定。
色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液(用10%氫氧化鈉溶液調節pH至7.5)-乙腈(80:20)為流動相;檢測波長為243納米。理論板數按順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺峰計算應不低於1500。
測定法取順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺約0.1克,置10毫升量瓶中,加流動相溶解,並稀釋至刻度,搖勻,作為供試品溶液;精密量取供試品溶液各20微升,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。
按面積歸一化法計算,RRT=0.43的雜質不得大於0.5%;RRT=0.65的雜質不得大於0.1%;RRT=0.78的雜質不得大於0.30%;RRT=0.87的雜質不得大於0.4%;順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺不得小於99.0%。
取按實施例1、實施例2方法製備的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺,批號為:060101、060102、060103、060104,按上述方法進行檢測,結果見表2,圖11-14。
| |
| | | | 順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺 |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
上述測定結果證明,實施例1、2製備的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度均高於99%。
實施例4
該發明枸櫞酸坦度螺酮的製備
為特定的季胺鹽,其中代表Cl,Br,I,CH3SO3。
順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺與特定的季胺鹽類縮合得坦度螺酮鹼,在無水乙醇溶液中與枸櫞酸成鹽得枸櫞酸坦度螺酮粗品,用15倍量無水乙醇進行重結晶得成品。
具體製備方法為:將順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺(純度均大於99%,由實施例1或實施例2製備)16.5千克(100摩爾)、季胺鹽100摩爾(
溴化物、氯化物、碘化物、甲磺酸物均可以)、N,N-二甲基甲醯胺230L、無水碳酸鉀42千克加入到反應器中,保溫113-157℃攪拌反應5-10小時。反應完畢,反應液冷卻至室溫攪拌下緩慢加入500-900千克水中,再充分攪拌,靜置,抽濾,濾餅用水充分洗滌二次。將濾餅用乙酸乙酯溶解,加入鹽酸溶液酸化,至pH2-3,分出酸液,於酸液中加活性炭適量,充分攪拌,冷脫色,過濾。濾液用氫氧化鈉溶液調pH值至10-11,產生類白色沉澱,攪拌,靜置,抽濾,濾液回收,濾餅用飲用水充分洗滌二次,充分抽乾;乾燥得白色或類白色坦度螺酮鹼34.5±3.9千克。收率範圍:90±5%,收率=坦度螺酮鹼重量/(順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺重量×2.32)×100%。
通過保溫溫度的篩選結果見下表,表明保溫溫度在125±2℃最為合適。
實施例5
該發明枸櫞酸坦度螺酮的質量控制方法:有關物質照高效液相色譜法(中國藥典2005年版二部附錄VD)測定。
色譜條件與系統適用性試驗用十八烷基矽烷鍵合矽膠為填充劑;0.01摩爾/升磷酸二氫鉀溶液(用10%氫氧化鈉溶液調節pH至7.5)-乙腈(60:40)為流動相;檢測波長為243納米。理論板數按坦度螺酮峰計算應不低於5000。
測定法取本品約50毫克,置100毫升量瓶中,加流動相溶解,並稀釋至刻度,搖勻,作為供試品溶液;精密量取1毫升,置100毫升量瓶中,加流動相稀釋至刻度,搖勻,作為對照溶液(I);另取化合物I對照品適量,加流動相製成每1毫升中約含2.5微克的溶液,作為對照品溶液(II);再取化合物II對照品適量,加流動相製成每1毫升中約含2.5微克的溶液,作為對照品溶液(III)。精密量取對照溶液(I)20微升,注入液相色譜儀,調節檢測靈敏度,使主成分色譜峰的峰高約為滿量程的20~25%;再精密量取供試品溶液、對照溶液(I)、對照品溶液(II)、對照品溶液(III)各20微升,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的2倍。供試品溶液的色譜圖中如顯示雜質峰,各雜質峰面積的和,不得過對照溶液(I)的主峰面積(1.0%),其供試品溶液中如出現化合物I,其峰面積不得過對照溶液(II)的主峰面積(0.5%),其供試品溶液中如出現化合物II,其峰面積不得過對照溶液(III)的主峰面積(0.5%)。見圖1-圖10
取實施例4製備的樣品,批號為:060101、060102、060103、060401、060402、060501、060502,按上述方法進行檢測,結果見表1。
結果表明:以上多批樣品的有關物質均符合質量標準草案的要求。
結果表明:以上多批樣品的純度均符合順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺質量控制的要求。
實施例6
採用純度低於99%的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺製備坦度螺酮鹼的試驗採用純度低於99%的順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺,按實施例4的方法製備:將順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺165克(純度98%)、季胺鹽386克(溴化物)、N,N-二甲基甲醯胺230毫升、無水碳酸鉀420克加入到反應器中,保溫113-157℃攪拌反應5-10小時。反應完畢,反應液冷卻至室溫攪拌下緩慢加入6千克水中,再充分攪拌,靜置,抽濾,濾餅用水充分洗滌二次。將濾餅用乙酸乙酯溶解,加入鹽酸溶液酸化,至pH2-3,分出酸液,於酸液中加活性炭適量,充分攪拌,冷脫色,過濾。濾液用氫氧化鈉溶液調pH值至10-11,產生類白色沉澱,攪拌,靜置,抽濾,濾液回收,濾餅用飲用水充分洗滌二次,充分抽乾。乾燥得白色或類白色坦度螺酮鹼300克。將坦度螺酮鹼300克,一水合枸櫞酸164克,無水乙醇3600毫升加入反應釜內,升溫到80℃,回流30分鐘,放冷至室溫,靜置,抽濾,用無水乙醇洗滌,乾燥,得枸櫞酸坦度螺酮430克。經按實施例5提供的方法檢驗,有關物質為:
上述試驗證明,該發明順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度是決定能否製備成符合該發明要求的枸櫞酸坦度螺酮的因素,通過限定順式-外-二環[2.2.1]庚烷-2.3-二甲醯亞胺的純度,可以實現該發明的目的。
實施例7
該發明藥物組合物的製備:坦度螺酮0.157摩爾(約相當於60克坦度螺酮)、羥丙基甲基纖維素(HPMCK4M)64.8克、75%乙醇適量、乳糖110克、硬酯酸鎂3克、滑石粉6克。
製備工藝:將實施例4製備的坦度螺酮原料藥與羥丙基甲基纖維素、乳糖、混合均勻,過篩,加入75%乙醇溶液制軟材,過20目篩制濕顆粒,於50℃左右烘乾,20目篩整粒,加入硬脂酸鎂和滑石粉,混合均勻後壓片。共制1000片。
實施例8
該發明藥物組合物的製備:坦度螺酮0.313摩爾(約相當於120克坦度螺酮)、澱粉200克、微晶纖維素5克。
製備工藝:將實施例4製備的坦度螺酮與澱粉通過等量遞增法混勻後,再與微晶纖維素混勻,制粒,壓片,即得片劑;或裝膠囊,即得膠囊劑。
實施例9
該發明藥物組合物的製備:枸櫞酸坦度螺酮0.052摩爾(約相當於20克坦度螺酮)、澱粉230克、微晶纖維素25克。
將實施例4製備的枸櫞酸坦度螺酮與澱粉通過等量遞增法混勻後,再與微晶纖維素混勻,制粒,裝膠囊,即得膠囊劑。
實施例10
該發明藥物組合物的製備:坦度螺酮0.157摩爾(約相當於60克坦度螺酮)、生理鹽水2000毫升。
製法:以適量的生理鹽水溶解,溶液濾至澄明,在濾器上加注射用水至2000毫升,罐封,滅菌,即得注射劑1000支。
實施例11
該發明藥物組合物的製備:枸櫞酸坦度螺酮0.052摩爾(約相當於20克坦度螺酮)、注射用水2000毫升。
製法:以適量的注射用水溶解,溶液濾至澄明,在濾器上加注射用水至2000毫升,罐封,滅菌,即得注射劑1000支。
實施例12
該發明藥物組合物的製備:枸櫞酸坦度螺酮0.078摩爾(約30克坦度螺酮)、糖粉400克、糊精200克、可溶性澱粉400克、矯味劑1克。
將實施例4製備的枸櫞酸坦度螺酮與糊精通過等量遞增法混勻,再與其他輔料混勻,制粒即得1000袋顆粒。
實施例13
該發明藥物組合物的製備:枸櫞酸坦度螺酮0.131摩爾(約50克枸櫞酸坦度螺酮)、矯味劑1.5克、蒸餾水適量、澱粉80克、糊精20克。
將實施例4製備的枸櫞酸坦度螺酮與澱粉通過等量遞增法混勻後,再與糊精、矯味劑混勻,乏丸,乾燥即得,1000粒丸劑。
試驗案例
為探索限定了化合物I和化合物II的枸櫞酸坦度螺酮與2008年7月前已有的枸櫞酸坦度螺酮區別。進行了質量標準提高前後的對比研究,獲得了大量有效可靠的試驗數據,結論如下:
試驗例1
臨床上多中心的開放性實驗
提高質量組:其中化合物I(0.05%)、化合物II(0.06%);原質量組:其中化合物I(0.6%),化合物II(0.7%)。
該發明藥物在全國進行了多中心開放性的臨床觀察實驗,採用漢密爾頓焦慮量表(HAMA)和臨床總體印象量表(CGI)作為療效判定工具,以藥物不良反應量表(TESS)評價藥物的安全性。以HAMA作為主要評價指標,並以HAMA減分率判定療效。在高質量組1107例隨訪病例中,總有效率為76.54%,不良反應發生率為6.8%,均為輕度。主要為胃腸反應,少見頭暈、嗜睡、心慌和皮疹。在未提高質量標準組的1205例隨訪病例中,總有效率為65.4%,不良反應發生率為11.4%,多為輕度,個別為中度。最多見的不良反應為頭昏、嗜睡和胃腸反應。
臨床觀察結果表明,通過將化合物I和化合物II作為藥效和不良反應的參考指標,枸櫞酸坦度螺酮在提高質量標準後,臨床抗焦慮的效果有顯著提高,而不良反應卻有明顯的降低。
試驗例2
抗焦慮動物模型實驗
1、高架十字迷宮實驗
將50隻健康小鼠隨機分成5組,每組10隻,各給藥組按表1所示藥物連續灌胃給藥5天,1次/天,末次給藥60分鐘後,將小鼠置於高架十字迷宮中央開闊部,頭朝閉臂(高架十字迷宮包括兩個開臂(長30厘米,寬6厘米)與兩個閉臂(長30厘米,寬6厘米,高10厘米),閉臂上部敞開,中央有一5×5厘米的開闊部,迷宮距地面高50厘米)。通過DigBehv動物行為分析系統2.0自動記錄5分鐘內動物進入開臂與閉臂的次數及在開臂與閉臂內及迷宮中央區內的運動時間及運動距離。以進入開臂次數與總入臂次數的百分比及在開臂內運動時間與開臂閉臂內的總時間的百分比代表抗焦慮作用指標。(見表2)
結果顯示,地西泮組和質量標準提高組可明顯或顯著增加小鼠進入開臂的次數、開臂滯留時間及其百分比(P<0.05或P<0.01),抗焦慮作用的提高是顯著的。
2、對小鼠爬梯(the staircase test)行為的影響
當小鼠被引入一個新環境時會出現焦慮反應,如警覺性行為增加。爬梯行為評價探究行為或活動性的指標,直立則作為焦慮狀態的參數,抗焦慮劑在不減少爬梯數的劑量下使站立數減少。
小鼠50隻,雌雄各半,按體質量、性別均衡隨機分為5組,按表2所示藥物灌胃給藥,給藥後30分鐘將小鼠置於箱的底部,背朝樓梯,用數碼攝像機拍攝小鼠行為,實驗者離開以減少干擾。記錄3分鐘內小鼠爬梯數(以四肢都爬上樓梯為準)和站立數。每天18:00~21:00點紅燈下進行實驗,每隻動物實驗結束後迅速清潔實驗箱,以排除嗅覺暗示對下一隻動物的干擾。
結果顯示,各給藥組爬梯數雖然減少但無顯著差異,而可明顯、顯著減少站立數(P<0.01和P<0.05),而又以高質量組效果最顯著,提示其抗焦慮作用較強。
| | | |
| | | |
| | | |
10毫克原質量組[化合物I(0.6%)化合物II(0.7%)] | | | |
10毫克提高質量組[化合物1(0.15%)化合物II(0.29%)] | | | |
10毫克提高質量組[化合物1(0.05%)化合物II(0.06%)] | | | |
註:表中為各給藥組與正常對照組比較*P<0.05,**P<0.01; 提高質量組與原質量組比較△P<0.05,△△P<0.01 |
|
3、大鼠社會應激動物模型與行為影響
雄性Sprague-Dawley大鼠,體重200-300克,按照Miscek的方法,雄性大鼠長期單獨飼養。實驗開始時,將實驗組大鼠放入單獨飼養大鼠籠中,單獨飼養鼠會攻擊實驗鼠,撒咬侵入者的頸部與背部。在第一次攻擊發生後實驗持續8分鐘,允許10分鐘作為攻擊潛伏期。實驗大鼠至少受到一次攻擊,並且表現出馴服的姿勢,如防禦性直立,仰臥,靜止不動等為社會失敗(social defeat)。社會失敗(social defeat)具有明顯的產生應激後焦慮行為的作用。
採用反映焦慮情緒的高架十字迷宮(plusmaze)法和空場實驗進行行為測驗。高架十字迷宮包括兩條開放臂(50×10厘米)和兩條閉合臂(50×10×40厘米),由中央區(10×10厘米)聯結,室內為暗光(80勒克斯)。實驗過程伴白噪聲。單盲,觀察者分別觀察每組50%的動物。大鼠從中央格面向閉合臂放入迷宮,記錄5分鐘內活動的情況,觀察指標:(1)閉合臂進入次數(必須有兩隻前爪進入臂內);(2)開放臂進入次數;(3)閉合臂停留時間;(4)開放臂停留時間。b.反映探究活動及情緒反應的空場實驗(openfield method):木製箱100×100×50厘米,地板用筆劃成25方格20×20厘米,沿牆格稱外周格,其餘為中央格。將動物放在正中央格,觀察12分鐘內活動情況。觀察指標(1)方格間穿行次數:三爪以上跨入鄰格的次數;(2)豎起或修飾次數:兩前肢離地1厘米以上的次數;(3)中央格停留時間。實驗結果用SPSS統計軟體分析,均用均數±標準差(±SD)表示。多個樣本均數比較用單因素方差分析,兩組間均數的比較採用獨立樣本t檢驗,顯著性水平p<0.05。
結果顯示,各組有抗社會失敗(social defeat)所產生應激後焦慮行為的作用。其中高質量組的抗應激焦慮的作用強於其它組。
| | | |
| | | |
| | | |
| | | |
10毫克原質量組[化合物I(0.6%)化合物II(0.7%)] | | | |
10毫克提高質量組[化合物I (0.15%)化合物II(0.29%)] | | | |
10毫克提高質量組[化合物I (0.05%)化合物II(0.06%)] | | | |
註:表中為各給藥組與正常對照組比較*P<0.05,**P<0.01; 提高質量組與原質量組比較△P<0.05,△△P<0.01 |
| | | | |
| | | | |
| | | | |
| | | | |
10毫克原質量組[化合物I(0.6%)化合物II(0.7%)] | | | | |
10毫克提高質量組[化合物I(0.15%)化合物II(0.29%)] | | | | |
10毫克提高質量組[化合物I(0.05%)化合物II(0.06%)] | | | | |
註:表中為各給藥組與正常對照組比較*P<0.05,**P<0.01; 提高質量組與原質量組比較△P<0.05,△△P<0.01 |
根據10毫克提高質量組[化合物I(0.05%)化合物II(0.06%)]的藥效試驗,發明人根據本領域技術人員對產品質量控制限定的規則,進一步地將化合物I和化合物II限定為不高於0.1%。
通過上述藥理對比研究可知,在限定了“化合物I的重量百分含量不得高於0.5%,含有化合物II的重量百分含量不得高於0.5%”的範圍內的提高質量組枸櫞酸坦度螺酮在抗焦慮的作用明顯高於原質量組,且隨著化合物I、化合物II的含量的減少,藥效明顯提高,其中,“化合物I的重量百分含量為:0%-0.3%,含有化合物II的重量百分含量為:0%-0.3%。”為進一步優選的範圍,“含有化合物I的重量百分含量為:0-0.1%,含有化合物II的重量百分含量為:0-0.1%”為更進一步優選的範圍;臨床上多中心的開放性實驗結果也表明:枸櫞酸坦度螺酮的臨床抗焦慮的效果有顯著提高、不良反應降低。說明通過將化合物I、化合物II作為指標成分控制,在該發明限定的範圍內,可有效的提高枸櫞酸坦度螺酮的藥效,降低不良反應。
| | | | | | | |
| | | | | | | |
| | | | | | | |
10毫克原質量組[化合物1(0.6%)-化合物II(0.7%)] | | | | | | | |
10毫克提高質量組[化合物I(0.15%)化合物II(0.29%)] | | | | | | | |
10毫克提高質量組[化合物I(0.05%)化合物II(0.06%)] | | | | | | | |
註:表中為各給藥組與正常對照組比較*P<0.05,**P<0.01; 提高質量組與原質量組比較△P<0.05,△△P<0.01 |
榮譽表彰
2014年11月6日,《枸櫞酸坦度螺酮及其製備方法、製劑和質量控制方法》獲得第十六屆中國專利優秀獎。