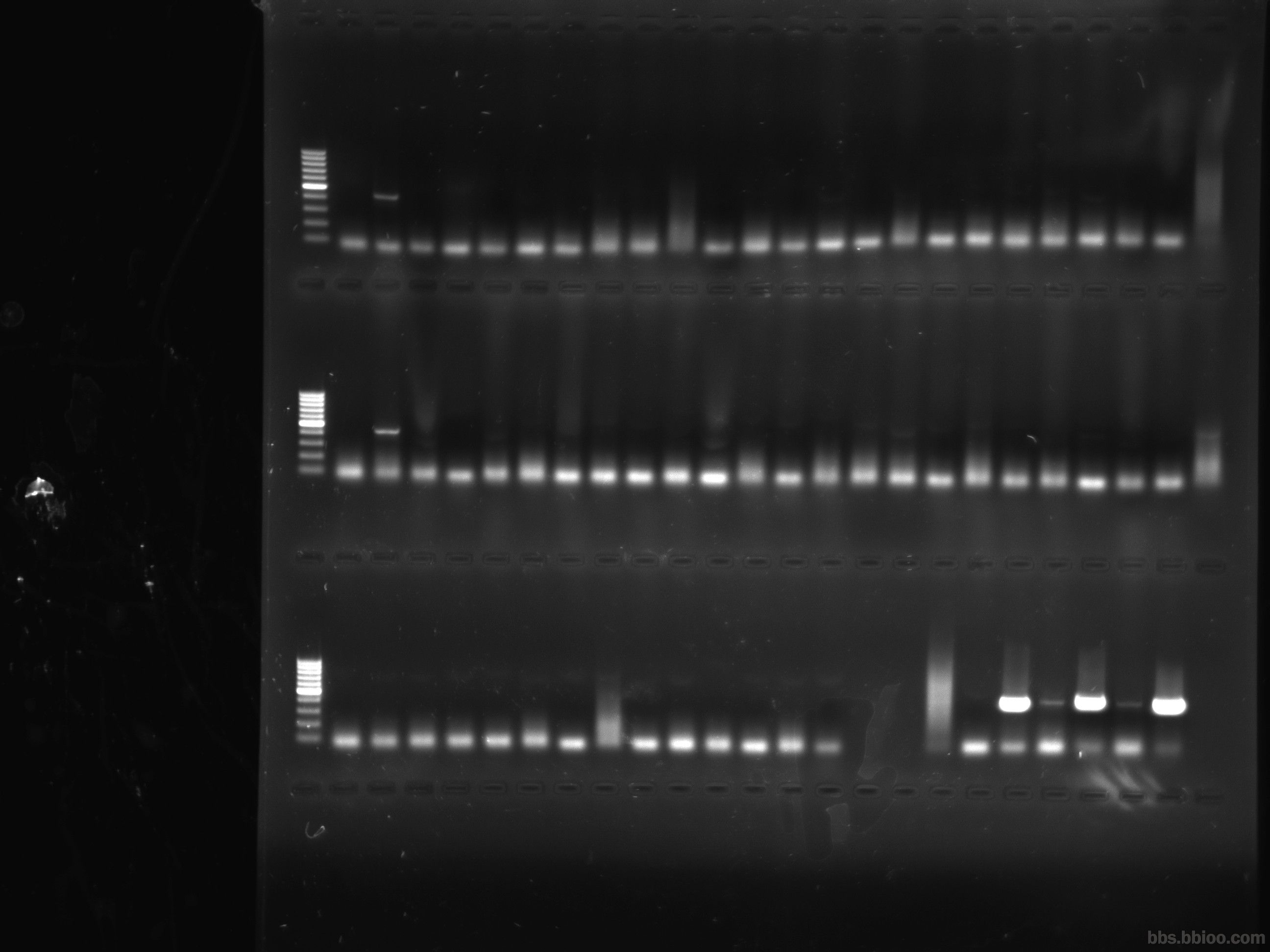
引物二聚體是引物的3'端間相互錯配擴增形成的。引物二聚體的出現是必然的,只是或多或少的問題,電泳時看不到引物二聚體帶也不代表沒有二聚體出現,只是含量低我們 的肉眼看不到而已。提高PCR嚴謹性(包括提高退火溫度,降低引物濃度等)可大大降低二聚體的濃度。
基本介紹
- 中文名:引物二聚體
- 外文名:primer dimer
方法:
1從引物自身 著手,重新設計引物,這是最根本解決這一問題的辦法;
2.可能模板有問題;模板濃度過小,適當加大模板量;
3.Taq酶,引物,Mg2+濃度可能過高,可 降低它們的濃度;
4.取你所要加的上下游引物混合後,在100攝氏度下的沸水中煮5分鐘,然後迅速拿出至於冰塊之上瞬時冷卻,這時再加入反應體系當中,引 物二聚體就會消失的;理由:引物可能會發生髮夾結構,自身環化等結構,在100攝氏度下的沸水中煮5分鐘可使引物變為單鏈,以減少二聚體。不過有人認為在 PCR儀上95度變性5min也同樣達到目的,而且成功試過通過延長退火時間也可以消除引物二聚體。
5.所配MIX中加5%的甘油或者5%的DMSO,可 以增強特異性;
6.PCR反應體系的配製在冰上進行,最後加TAq酶,PCR結束後,產物勿放置在室溫下過長時間,有人認為室溫下有些TAQ酶會將多餘的 引物合成為二聚體。
7.減少循環數;
8.降低退火溫度後有條帶,則應逐漸提高溫度,若提高溫度的同時產物量減少,則考慮增加鎂離子濃度(根據擴增片斷長度 而定,片段長則相應鎂離子濃度應該高一些);
9.若提高退火溫度,發現還是只有引物二聚體,而且鎂離子的濃度在20-25mmol/l沒有區別,則考慮 Buffer等試劑沒有完全融解、混勻,導致吸取的試劑濃度不對。
10.以上次的pcr產物作模板二次pcr,可以提高引物與模板的特異性,減少引物二聚 體,如果兩次時間間隔短的話,可以把原產物稀釋100-1000倍,如果間隔較長可以稀釋50-100倍;
7.減少循環數;
8.降低退火溫度後有條帶,則應逐漸提高溫度,若提高溫度的同時產物量減少,則考慮增加鎂離子濃度(根據擴增片斷長度 而定,片段長則相應鎂離子濃度應該高一些);
9.若提高退火溫度,發現還是只有引物二聚體,而且鎂離子的濃度在20-25mmol/l沒有區別,則考慮 Buffer等試劑沒有完全融解、混勻,導致吸取的試劑濃度不對。
10.以上次的pcr產物作模板二次pcr,可以提高引物與模板的特異性,減少引物二聚 體,如果兩次時間間隔短的話,可以把原產物稀釋100-1000倍,如果間隔較長可以稀釋50-100倍;