公司簡介
匯宇製藥是一家研發驅動的綜合製藥企業,主要從事抗腫瘤和注射劑藥物的研發、生產和銷售。
企業文化
願景:成為一家受人尊敬的國際化製藥企業
企業使命:為全球患者提供療效確切、質量精湛、價格合理的藥品,讓癌症成為一種可以控制的慢性病
核心價值觀:關愛生命,追求卓越,簡單誠信
獲得榮譽
2018 年,榮獲四川省工程實驗室
2019年,榮獲四川省“引才引智基地”
2019年,榮獲四川省“高成長型中小企業”
2020年,榮獲四川省“綠色工廠”
發展歷程
2010年,匯宇製藥註冊成立
2011年,英國子公司海玥註冊
2013年,內江中歐共線生產基地啟用
2014年,先後通過英國和中國GMP認證
2015年,英國海玥取得歐盟藥品放行資質認證並在英國上市銷售
2017年,培美曲塞獲批視同通過一致性評價的注射劑
2018年,注射用培美曲塞中標“4+7”集采,榮獲國家高新技術企業企業
2019年,多西他賽注射液獲批通過一致性評價、注射用阿扎胞苷首仿通過一致性評價
2020年,注射用阿扎胞苷中標第三批國家集采、遞交科創板IPO申請、匯宇歐盟標準注射劑產業化基地(二期)項目啟動、匯宇創新藥物研究院建設項目奠基
2022年4月,公司產品左乙拉西坦注射用濃溶液已獲批註冊,藥品批准文號:國藥準字H20223181。
2022年5月,匯宇製藥公告,公司全資子公司 Seacross Pharma(Europe) Limited於收到德國藥監局核准簽發的關於公司產品奧沙利鉑注射用濃溶液的上市許可。
2022年6月,匯宇製藥公告,公司全資子公司Seacross Pharmaceuticals Ltd.收到英國藥品和健康產品管理局核准簽發的關於公司產品普樂沙福注射液的上市許可。
2022年6月30日,公司收到國家藥監局核准簽發的《藥品註冊證書》,普樂沙福注射液與粒細胞集落刺激因子(G-CSF)聯用,適用於非霍奇金淋巴瘤(NHL)和多發性骨髓瘤(MM)患者動員造血幹細胞(HSC)進入外周血,以便於完成HSC採集與自體移植。
2022年8月,匯宇製藥多西他賽注射液獲得德國上市許可。
2022年9月1日,匯宇製藥公告,公司全資子公司SeacrossPharma(Europe)Limited於近日收到義大利藥監局核准簽發的關於公司產品注射用阿扎胞苷的上市許可。
2023年2月,匯宇製藥公告,公司產品普樂沙福注射液獲得法國藥監局核准簽發的上市許可。
2023年5月6日,四川匯宇製藥股份有限公司收到國家藥品監督管理局核准簽發的《藥品註冊證書》。
2023年7月10日,匯宇製藥晚間公告,公司近日收到國家藥監局核准簽發的唑來膦酸注射液《藥品註冊證書》。
2023年7月13日,匯宇製藥公告,公司全資子公司Seacross Pharma (Europe) Ltd.於近日收到西班牙藥物和健康產品管理局核准簽發的關於公司產品普樂沙福注射液的上市許可。
2023年7月29日,匯宇製藥發布公告,苯磺順阿曲庫銨注射液和注射用唑來膦酸濃溶液收到國家藥品監督管理局核准簽發的《藥品註冊證書》,獲批上市。
2024年2月20日,匯宇製藥發布公告,公司的多西他賽、注射用鹽酸苯達莫斯汀、唑來膦酸注射液獲埃及藥品管理局批准上市。
研發實力
研發團隊
經過多年的發展與培養,匯宇製藥已匯聚一批專業的技術、管理和銷售人才,形成了一支專業背景突出、研發經驗豐富的研發團隊。截至2020年12月末,公司擁有員工999人,其中博士和碩士總計122人,大學本科學歷人員499人,大學及大學以上人員占總人數的62.16%,已形成較為科學的人才培養梯隊。截至2020年12月末,公司研發團隊393人,占公司員工的比例為39.34%。公司的核心技術人員為7人。
研發平台
匯宇製藥的先進技術及技術平台包括化學仿製注射劑一致性評價技術平台 、複雜注射劑生產與質量控制技術平台 、原料藥生產質量控制技術平台(包括手性藥物研發平台、結晶純化平台、製備純化平台),以及符合歐盟標準的生產質量管理體系和高效的國際註冊體系。
2021年,公司原料藥研發投入達近7900萬元,並啟動了近40個製劑項目和原料藥項目技術轉移、其中27個製劑項目和原料藥項目完成工藝驗證生產。在原料藥生產基地方面,2021年公司完成了兩條原料生產線的建設,並已投入試生產。
匯宇製藥成立了藥物研究四所,專注於抗腫瘤藥物,特別是腫瘤免疫相關藥物的研發,將涉及多特異性抗體、抗體偶聯藥物(ADC)、mRNA腫瘤疫苗等,加快新藥研發速度。
受益於上述研發平台及技術,公司在國內已經申報審批的藥品包括鹽酸伊立替康注射液、紫杉醇注射液等9個品種。在國際市場,公司自主獲批和授權獲批的產品批件總數超過100個。在國內市場,公司為注射用阿扎胞苷產品視同通過一致性評價的國內兩家首仿企業之一。注射用培美曲塞二鈉獨家中選“4+7”帶量採購,並與原研藥廠家共同中選聯盟地區帶量採購,注射用阿扎胞苷已於2020年8月中選國家第三批藥品集中採購。注射用培美曲塞二鈉、多西他賽注射液、唑來膦酸注射液等品種已經實現大規模銷售並成為公司主要利潤來源。
研發規劃
匯宇製藥未來3年的化學藥1類創新藥研發主要以搭建化學藥研發技術平台來推動新藥研發,包括建立藥化技術平台、體內外生物篩選平台、ADME(吸收、分布、代謝、排泄)篩測平台、體內PK(藥物代謝動力學)篩選平台、化學工藝平台、PROTAC設計和篩選平台等多種新藥研發平台。
產品目錄
國內已上市產品:注射用培美曲塞二鈉、多西他賽注射液、注射用阿扎胞苷、紫杉醇注射液、奧沙利鉑注射液、注射用鹽酸苯達莫司汀、伊立替康注射液。
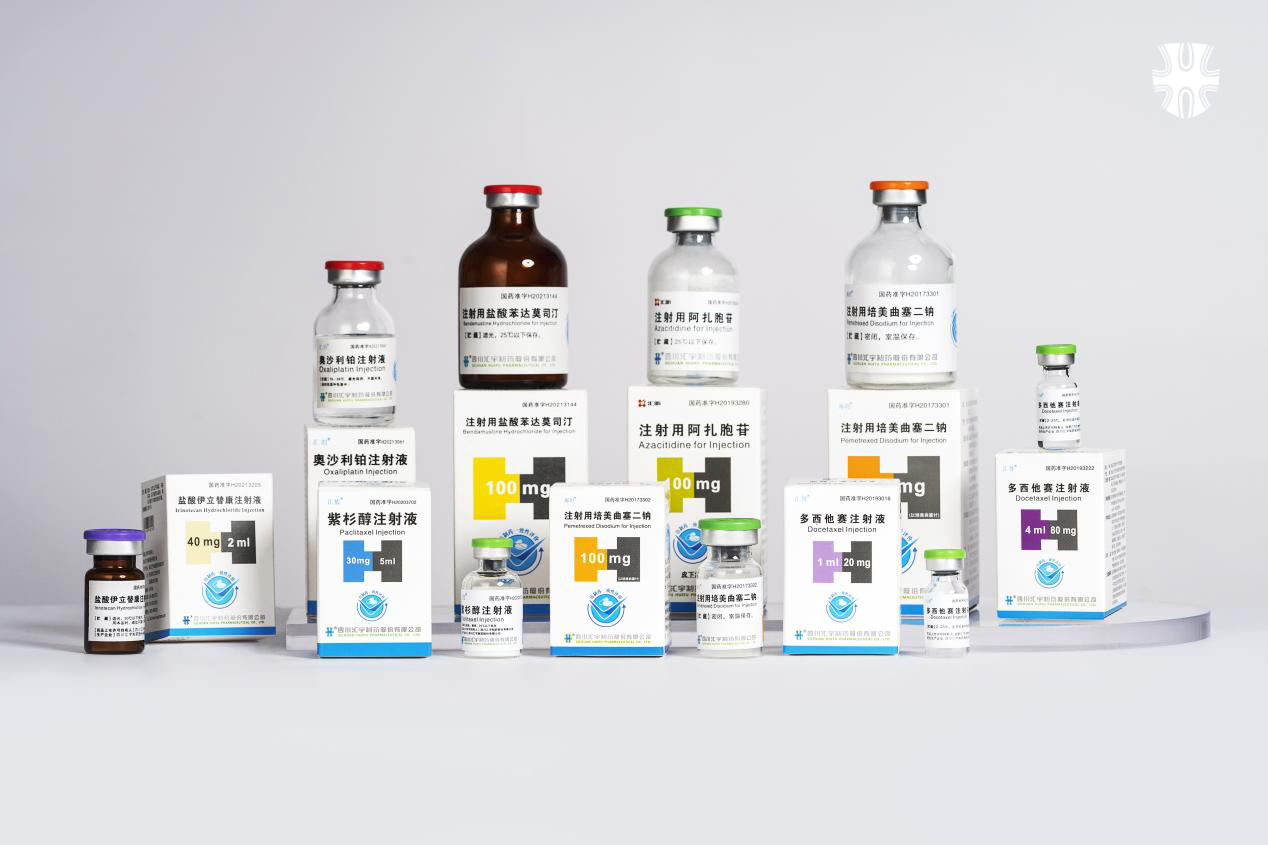
匯宇製藥產品圖
在研項目
匯宇製藥在研項目總共87個,其中原料藥、輔料項目32個,仿製藥製劑項目42個,在研項目中包含抗腫瘤相關藥品33個,其中包含1類新藥項目10個,改良型新藥項目1個。
產品質量
質量方針:患者第一,質量至上
嚴格把控流入市場的每一瓶藥,為每一位患者保駕護航,讓生命更加有尊嚴的延續
匯宇製藥始終秉承“質量至上”的核心要求,將藥品質量風險管控貫穿於藥品研發、技術轉移、商業化生產、產品退市的整個產品生命周期。
從生產過程監控到產品上市放行,始終以標準、真實的數據對藥品質量做出準確的評價,確保生產和檢測過程的每一步經過嚴格的驗證程式,從而保障穩定的產品質量。
匯宇製藥生產線按德國美施威爾公司的設計理念,全面結合歐美及中國最新GMP 要求進行設計建設,實施PMS(線上粒子監測系統)、BMS(潔淨室環境監控系統)及PAT(生產過程分析和控制系統)等生產全過程控制技術,能夠追溯每一瓶產品的生產全過程,確保每一瓶產品的質量。
公司生產線採用全密閉隔離器、CRABS(封閉式限制性進入屏障系統)、 VHP 滅菌(汽化雙氧水滅菌法)、凍乾機自動進出料、CIP(線上清洗)/SIP(線上滅菌)/線上稱重等國際前沿技術,杜絕了人為干擾造成產品污染的風險;生產工藝實現全流程低溫生產技術,降低了雜質產生和活性物質降解的風險。
海外市場
匯宇製藥依據歐盟GMP、美國FDA cGMP 法規要求,建立了嚴謹的質量管理體系。多次通過了英國藥監機構(MHRA)的GMP 認證,MHRA 的GMP 認證自動獲得歐盟27 國、大英國協53 國的認可。
2021年,公司實現海外收入6729萬元,同比增長144%,較2020年新增實現銷售國家11個,累計在超過40個國家實現銷售。近三年,海外收入複合增長率73%。同時公司已在美國設立子公司,為推進創新藥項目海外授權提供支持,為複雜注射劑等重點產品在美國上市鋪平道路。
匯宇製藥普樂沙福注射液在英國獲得註冊批件,是首家在英國獲得該仿製藥批准的企業。目前,匯宇在英國市場自主持有批件產品已有15個。
旗下子公司
1、英國海玥
英國海玥,全稱SEACROSS PHARMACEUTICALS LTD
2、UNI SOLIDARITY
UNI SOLIDARITY,全稱UNI SOLIDARITY LIMITED
3、愛爾蘭海玥
愛爾蘭海玥,全稱SEACROSS PHARMA (EUROPE) LIMITED
4、四川澤宇
四川澤宇,全稱四川澤宇藥業有限公司
5、匯宇海玥
匯宇海玥,全稱四川匯宇海玥醫藥科技有限公司
6、藥業科技
藥業科技,全稱四川匯宇藥業科技有限公司
7、匯宇匯昕
匯宇匯昕,全稱四川匯宇匯昕醫藥科技有限公司
8、匯宇生物
匯宇生物,全稱成都匯宇生物技術有限公司
9、海玥藥業
海玥藥業,全稱海玥藥業(四川)有限公司
10、藥物研究
藥物研究,全稱四川匯宇藥物研究有限公司


