基本概述
在討論分子的極性時,只考慮孤立分子中電荷的分布情況,如果把分子置於外電場中,則電荷分布要發生變化。
非極性分子在外電場的影響下,電子云與核分別向兩極移動,結果產生相對位移,分子發生變形(稱為分子的變形性),產生偶極,這個過程叫分子的極化變形,形成的偶極稱為誘導偶極。電場越強,分子變形性越大,誘導偶極越大。當外電場取消時,所形成的偶極也消失,分子重新變為非極性分子。對於極性分子來說,本身就存在偶極,這種偶極叫固有偶極或永久偶極。
非固態的極性分子,在沒有外電場的作用時,其分子的熱運動是不規則的,而在外電場中,分子的偶極矩就按電場的方向而取一定的方位,這個過程稱為取向;同時在電場影響下,分子也會發生變形,產生誘導偶極,這時分子的偶極為永久偶極與誘導偶極之和,分子的極性便有所增加。
分子的取向、極化和變形,不僅在電場中發生,而且在相鄰分子間也可以發生。每個極性分子的固有偶極可看成是一個電場,它可以使相鄰的極性分子或非極性分子極化變形。這種極化作用對分子間力的產生有重要影響。
影響分子變形性的因素
分子中的原子數越多,原子半徑越大(分子越大),分子中電子數越多,變形性越大。
分子變形性與分子內各元素是否達到穩定狀態(即最外層電子數是否為8),各元素原子核間相互吸引力。
還與元素間化學鍵的熱值因素有關。
分子變形程度的大小
非極性分子原來重合的正負電荷中心,在電場影響下互相分離,產生了偶極,此過程稱為分子的變形極化,所形成的偶極稱為誘導偶極(induction dipole)。電場愈強,分子變形愈大,誘導偶極愈大。若取消外電場,誘導偶極自行消失,分子重新復原為非極性分子,所以誘導偶極與電場強度E成正比。
P誘導=α·E
式中,引入比例
常數α,顯然α可作為衡量分子在電場作用下變形性大小的量度,稱為分子誘導極化率,簡稱為極化率(polarizability)。分子中電子數愈多,電子云更加彌散,則α愈大。如外電場強度一定,則α愈大的分子,
P誘導愈大,分子的變形性也愈大。
對於極性分子來說,本身就存在著偶極,此偶極稱為固有偶極或永久偶極(permanentdipole)。極性分子通常都作不規則的熱運動,如圖1(a)所示。若在外電場的作用下,其正極轉向負電極,其負極轉向正電極,按電場的方向排列,如圖1(b)所示,此過程稱為取向,亦稱分子的定向極化。
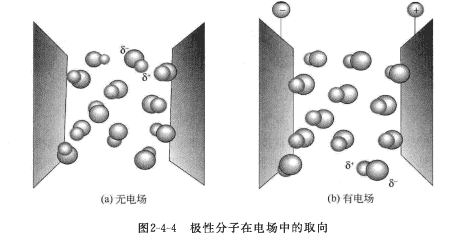
圖1 極性分子在電場中的取向
同時電場也使分子正負電荷中心之間的距離拉大,發生變形,產生誘導偶極,所以此時分子的偶極為固有偶極和誘導偶極之和,分子的極性有所增強分子的極化率α可由實驗測得。
表中數據表明,隨分子中電子數的增多以及
電子云彌散,α值相應加大。以周期系同族元素的有關分子為例,從He到Xe及從HCl到HI,α值增大,分子的變形性必然增大。
分子的取向、極化和變形,不僅在電場中發生,而且在相鄰分子間也可以發生。這是因為極性分子固有偶極就相當於無數個微電場,所以當極性分子與極性分子、極性分子與非極性分子相鄰時同樣也會發生極化作用。這種極化作用對分子間力的產生有重要影響。
分子極性與分子間力的關係
A.非極性分子之間存在色散力。
B.極性分子與非極性分子問存在色散力和誘導力。
C.極性分子之間存在色散力、取向力和誘導力。

