《一種N-苄基色胺酮衍生物及其製備方法和套用》是復旦大學於2013年11月12日申請的專利,該專利申請號為2013105605720,公布號為CN103570727A,公布日為2014年2月12日,發明人是楊青、匡春香。
《一種N-苄基色胺酮衍生物及其製備方法和套用》涉及一種N-苄基色胺酮衍生物及其製備方法和用途。該發明以靛紅及其衍生物為原料,氧化成靛紅酸酐。在三乙胺鹼性條件下,甲苯溶劑中與5-氟靛紅回流反應,過濾洗滌後得到甲基色胺酮。甲基色胺酮在二氯甲烷中與N-丁二醯亞胺回流,濃縮過濾得到黃色的單溴代的甲基色胺酮。單溴代的甲基色胺酮與脂肪胺,在二甲亞碸和鹼存在下,攪拌,萃取水洗得到所需產物。該發明所述的N-苄基色胺酮衍生物具有優良的吲哚胺-2,3-雙加氧酶(IDO)抑制活性,可套用於治療具有IDO介導的色氨酸代謝的病理學特徵的疾病,至少包括腫瘤、癌症、阿爾茨海默病、自身免疫性疾病、抑鬱症、焦慮症。該發明方法具有操作簡單、條件溫和、收率高等優點,易於工業化生產。
2021年6月24日,《一種N-苄基色胺酮衍生物及其製備方法和套用》獲得第二十二屆中國專利銀獎。
基本介紹
- 中文名:一種N-苄基色胺酮衍生物及其製備方法和套用
- 公布號:CN103570727A
- 申請人:復旦大學
- 發明人:楊青、匡春香
- 申請號:2013105605720
- 申請日:2013年11月12日
- 公布日:2014年2月12日
- 地址:上海市楊浦區邯鄲路220號
- 代理機構:上海正旦專利代理有限公司
- 代理人:張磊
- Int. Cl.:C07D487/04(2006.01)I;A61K31/519(2006.01)I;A61K31/5377(2006.01)I;A61P35/00(2006.1)I;A61P3/00(2006.1)I
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,操作內容,實施案例,專利榮譽,
專利背景
吲哚胺-2,3-雙加氧酶(簡稱IDO;MW 48,000;EC 1.13.11.42)是含有血紅素的酶,該酶是哺乳動物色氨酸代謝途徑中的第一個酶並且是限速酶。IDO催化必需胺基酸—色氨酸通過雙氧轉化為N-甲醯犬尿氨酸的氧化反應,並且負責清理人體中的色氨酸。IDO通過降解色氨酸,造成體內色氨酸缺失的微環境,進而導致了癌症、白內障、神經紊亂等多種與色氨酸缺失密切相關的疾病的發生。因此,尋找基於IDO靶點的高效抑制劑已成為藥物開發的研究熱點。截至2013年11月12日,已知1-甲基-L-色氨酸(1-MT)和β-(3-苯並呋喃基)-DL-丙氨酸等某些色氨酸(底物)類似物是IDO的競爭性抑制劑(Cady,S.G.and Sono,M.Arch.Biochem.Biophys.1991,291,326)。
干擾素γ是若干潛在的IDO表達誘導劑中的一種。在高水平干擾素γ刺激的持續活化期間,IDO降低了游離血清色氨酸的利用度,因而也減少了5-羥色胺的產生。這些變化與諸如喹啉酸的具有神經活性的犬尿氨酸代謝物的蓄積(也由IDO誘導)相結合,促進神經病/精神病病症的發生並且是多種心理障礙的誘因,也是具有IDO活化和色氨酸降解特徵的慢性病的相關症狀的誘因,所述慢性病例如獲得性免疫缺陷綜合症(AIDS)、阿爾茨海默病、多種類型的抑鬱症和癌症(Wirleitner,Curr.Med.Chem.2003,10,1581)。
IDO活性還涉及與年齡相關的核性白內障的發生。IDO是晶狀體中紫外線濾器生物合成中的第一個酶,並且是限速酶。來自色氨酸降解的紫外線濾器化合物(犬尿氨酸和3-羥基犬尿氨酸葡萄苷)修飾存在於人晶狀體中的蛋白質。這些紫外線濾器化合物的量隨著年齡增長而增加(Takikawa et al.Adv.Exp.Med.Biol.1999,241,467)並且已經報導了這些紫外線濾器化合物會導致晶狀體逐漸渾濁,進而導致被稱為與年齡相關的核性白內障。IDO抑制劑會阻斷該自然過程(Takikawa et al.Exp.Eye Res.2001,72,271)。
IDO表達還涉及通過阻止局部T-淋巴細胞增殖而進行的免疫應答抑制。T-淋巴細胞對色氨酸的缺乏非常敏感並且在色氨酸缺失條件下,T-淋巴細胞停滯在細胞周期的G1期。這種T細胞介導的免疫應答抑制是導致許多疾病的因素,所述疾病包括自身免疫性疾病、異體排斥反應、神經退行性病症、抑鬱症、細菌或病毒感染(例如人免疫缺陷病毒HIV)和癌症(Swanson et al.Am.J.Respir.Cell Mol.Biol.2003 30,311)。IDO抑制劑可以用於調節T細胞介導的免疫應答。
已經發現大多數人類腫瘤組成性地表達IDO。來自預先免疫小鼠的小鼠腫瘤細胞已經顯示可以通過表達IDO而保護其不受排斥反應,通過1-MT的給藥消除了上述效應。然後通過IDO抑制劑的伴行給藥改善了癌症治療的有效性(Uyttenhove et al.Nat.Med.2003,9,1269)。
IDO抑制劑可以用於心理障礙的抑制以及治療其他具有IDO介導的色氨酸代謝途徑的病理學特徵的疾病,這些疾病包括諸如AIDS等病毒的感染、諸如萊姆病和鏈球菌感染等細菌感染、神經退行性病症(例如阿爾茨海默病、亨廷頓病和帕金森病)、抑鬱症、癌症(包括T細胞白血病和結腸癌)、眼部疾病(例如白內障和與年齡相關的黃化)以及自身免疫性疾病。可以使用多種體外分析(Takikawa,et al.J.Biol.Chem.1998,263,2041)來篩選(例如高通量篩選)、測試反應參照物或從天然來源得到的提取物的IDO抑制劑活性,或確定其IDO抑制動力學常數。
截至2013年11月12日,IDO與多種疾病發病機制密切相關,已被證實它是癌症、阿爾茨海默病、抑鬱症、白內障等重大疾病的靶標,IDO抑制劑作為藥物具有廣闊的套用前景,但是仍未有合適的IDO抑制劑可作為藥物上市,因此尋找新型高效的IDO抑制劑具有重要的理論意義和套用價值。相關研究表明,IDO抑制劑1-MT(1-甲基色氨酸)在體外能增強腫瘤細胞對T細胞的免疫刺激的敏感性;在動物模型中能體內延緩腫瘤細胞的生長並增強化療藥物的抗腫瘤效果,而且對幾乎所有的自發性腫瘤都起作用,這給腫瘤的免疫治療帶來了新希望。1-MT被美國國立癌症研究所列入RAID(rapid access to intervention development)計畫,並於2007年秋進入I期臨床試驗。但遺憾的是相關的IDO抑制劑大都抑制效力低下,1-MT作為各種體內外實驗中常用的IDO抑制劑,其抑制常數Ki也僅為34微摩爾/升。因此,發現新型高效的IDO抑制劑具有重大套用價值。
色胺酮為吲哚喹唑啉類生物鹼,其化學名稱為吲哚[2,1-b]喹唑啉-6,12-二酮。色胺酮是一種黃色針狀結晶,主要存在於馬藍、蓼藍、菘藍等產藍植物中(Honda G,et al.Planta Medica,1980,38(3):275-276.)。另外,也可以從微生物的發酵液中提取(Hosoe T,et a1.Mycopathologia,1999,144(1):9-12.)。截至2013年11月12日,中國國內、外學者對色胺酮的藥理進行了部分研究,其藥理作用主要表現在抗菌、抗炎、抗腫瘤及抗寄生蟲(Oberthur C,et al.Fitoterapia,2005,76(3-4):324-332;Motoki T,et a1.Biol Pharm Bull,2005,28(2):260-266)等方面。雖然從蓼藍、馬藍、菘藍等產藍植物及微生物的代謝產物中可提取色胺酮,但其分離過程長、提取率低,難以滿足研究和臨床用藥的需求。只有通過探索耗時短、收率高、簡便易得的人工合成途徑才能為色胺酮的套用提供更多的資源,使其進一步的開發和套用成為可能。
截至2013年11月12日,藥物化學家一直致力於色胺酮及其衍生物的合成研究,合成色胺酮的主要方法是吲哚醌與靛紅酸酐反應,該方法簡單收率高、反應條件溫和。另外,可以在吲哚醌與靛紅酸酐兩種原料母體上引入功能化基團,可以合成各種功能化色胺酮。合成吲哚醌最主要的方法是利用水合三氯乙醛、羥胺和苯胺在鹽酸水溶液中反應生成肟類化合物,然後在濃硫酸作用下閉環得到吲哚醌,該方法非常適用於合成含鹵素和烷基的色胺酮,收率也較高。但該方法難以合成含活性基團的色胺酮,這是由於在合成吲哚醌的過程中,這些基團易於發生多種副反應。靛紅酸酐的合成方法主要有以下兩種。方法一:鄰氨基苯甲酸與三光氣反應,該方法收率高。但是在原料上引入活性基是仍然是非常複雜的。因此,功能化色胺酮的合成是對有機合成的挑戰。
發明內容
專利目的
為了克服專利背景中的不足,《一種N-苄基色胺酮衍生物及其製備方法和套用》對色胺酮進行了結構改造,以改善色胺酮的溶解性能和藥理活性,目的在於獲得有套用價值的活性化合物。該發明的研究和藥理試驗表明,在色胺酮分子中引入水溶性基團而形成的N-苄基色胺酮衍生物可以作為更高效的IDO抑制劑,其具有抗菌、抗炎、抗腫瘤等多種藥理活性,有廣闊的套用前景。此外,相比已有的色胺酮衍生物合成方法而言,該發明的合成方法具有操作簡單、條件溫和、收率高等優點,更易於工業化生產。
《一種N-苄基色胺酮衍生物及其製備方法和套用》的目的在於提供一種N-苄基色胺酮類衍生物及其製備方法和套用。
技術方案
該發明涉及所述的化合物、其互變異構形式、其結構類似物或其藥物可接受的鹽,以及含有至少一種該化合物、其結構類似物或其藥物可接受的鹽的組合物用於抑制IDO,以及在治療和/或預防具有IDO介導的色氨酸代謝途徑的病理學特徵的疾病中的用途。這樣的疾病包括但不限於,腫瘤、癌症、眼部疾病、自身免疫性疾病、心理障礙、抑鬱症和焦慮症。所述用途包括體內和體外套用,以及在製備藥物、IDO抑制劑和藥物組合物中的用途。
該發明提出的N-苄基色胺酮類衍生物,其結構通式如下: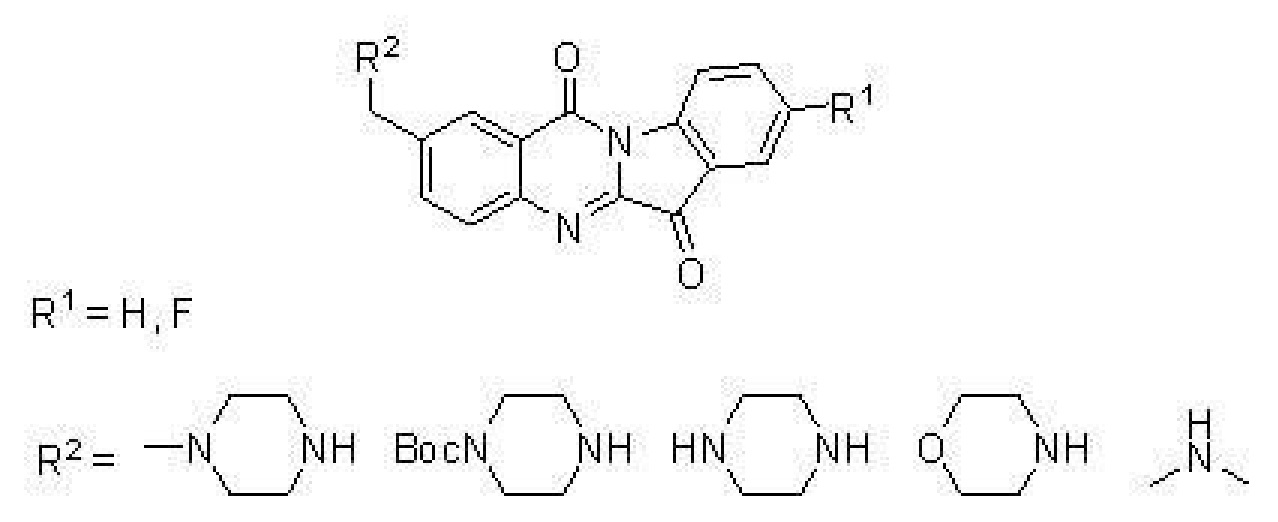

其中:所述取代基R為環狀亞胺或二烷基取代胺,R為氫或氟。
該發明提出的N-苄基色胺酮類衍生物的製備方法,其合成路線如下: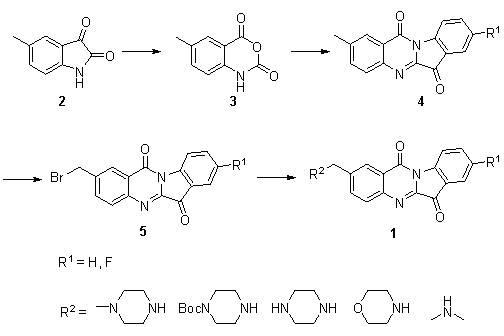

具體步驟如下:
(1)甲基靛紅酸酐(3)的合成
5-甲基靛紅懸浮於乾燥二氯甲烷中,在0攝氏度下分批加入間-氯過氧苯甲酸,在室溫下攪拌1.5-2.5小時;TLC檢測反應完全後,過濾反應形成的白色固體,用乙酸乙酯洗滌三次,得到5-甲基靛紅酸酐;其中,5-甲基靛紅和間-氯過氧苯甲酸摩爾比為:0.5-1:1。
(2)2-甲基色胺酮(4)的合成
將甲基靛紅酸酐、5-氟靛紅和三乙胺的混合物懸浮於乾燥甲苯中,在100-120攝氏度下加熱3.5-4.5小時,溶劑在減壓條件下蒸去,黃色的固體溶解於二氯甲烷中,再加入乙酸乙酯,形成的黃色固體經過濾用乙酸乙酯洗滌三次,得到2-甲基色胺酮;其中,甲基靛紅酸酐和5-氟靛紅和三乙胺摩爾比為:0.2-0.5:0.2-0.5:1。
(3)溴代2-甲基色胺酮(5)的合成
在75-85攝氏度和氮氣保護的條件下,將步驟(2)所得的2-甲基色胺酮溶解於乾燥的二氯甲烷中,然後分批加入NBS和AIBN的混合物。反應液在75攝氏度加熱15-17小時,TLC檢測反應完全。反應液冷卻到室溫後經鹽水洗滌,無水硫酸鈉乾燥,濃縮得到的黃色產物;其中,2-甲基色胺酮和NBS和AIBN摩爾比為:1:1:0.005-0.02。
(4)N-苄基色胺酮(1)的合成
將溴代2-甲基色胺酮、脂肪胺和三乙胺在乾燥DMF中於室溫下攪拌1.5-2.5小時,TLC檢測反應完全後,加入50毫升水,再用10毫升二氯甲烷萃取三次,合併的二氯甲烷相用水洗三次再用無水硫酸鈉乾燥。濃縮得到的黃色固體用矽膠分離,得到黃色的N-苄基色胺酮衍生物。其中,溴代2-甲基色胺酮和脂肪胺和三乙胺摩爾比為:1:1-2:2-5。
該發明提出的N-苄基色胺酮衍生物在製備預防和/或治療具有IDO介導的色氨酸代謝紊亂的病理學特徵的疾病的藥物中的用途。優選地,所述疾病選自腫瘤。
改善效果
利用《一種N-苄基色胺酮衍生物及其製備方法和套用》方法合成的N-苄基色胺酮衍生物,具有IDO抑制活性,同時也可以作為進一步修飾的藥物中間體,具有開發成新的治療癌症藥物的潛在套用價值。該合成路線具有操作簡便、反應條件溫和、節省溶劑、減少污染等優點,便於工業化生產。
技術領域
《一種N-苄基色胺酮衍生物及其製備方法和套用》屬於藥物化學技術領域,具體涉及一種N-苄基色胺酮衍生物及其製備方法和套用。
權利要求
1、一種N-苄基色胺酮類衍生物,其特徵在於所述衍生物的結構通式如下:
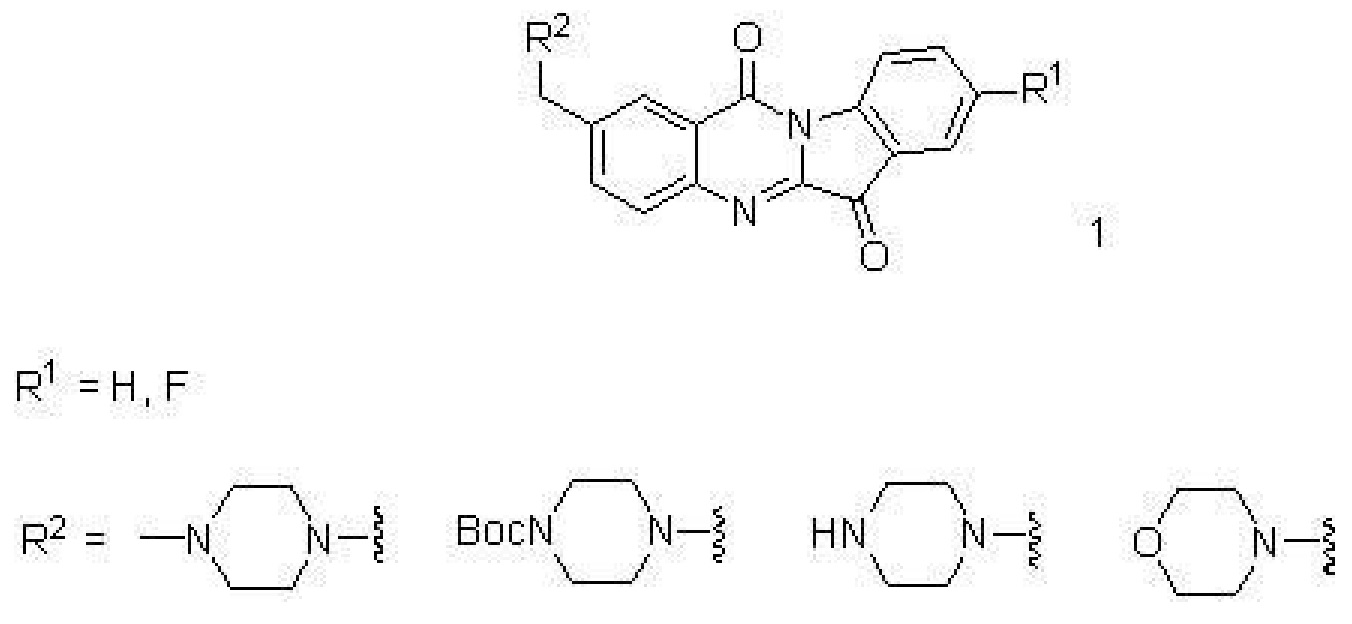
其中,“~~~”表示連線位點。
2、一種如權利要求1所述的N-苄基色胺酮類衍生物的製備方法,其特徵在於合成路線如下:
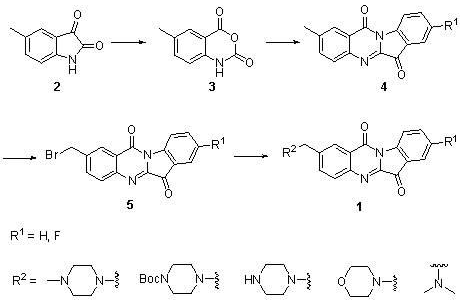
其中,“~~~”表示連線位點;
具體步驟如下:
(1)甲基靛紅酸酐(3)的合成
5-甲基靛紅懸浮於乾燥二氯甲烷中,在0攝氏度下分批加入間-氯過氧苯甲酸,在室溫下攪拌1.5-2.5小時;TLC檢測反應完全後,過濾反應形成的白色固體,用乙酸乙酯洗滌三次,得到5-甲基靛紅酸酐;其中,5-甲基靛紅和間-氯過氧苯甲酸摩爾比為:(0.5-1):1;
(2)2-甲基色胺酮(4)的合成
將甲基靛紅酸酐、5-氟靛紅和三乙胺的混合物懸浮於乾燥甲苯中,在100-120攝氏度下加熱3.5-4.5小時,溶劑在減壓條件下蒸去,黃色的固體溶解於二氯甲烷中,再加入乙酸乙酯,形成的黃色固體經過濾用乙酸乙酯洗滌三次,得到2-甲基色胺酮;其中,甲基靛紅酸酐和5-氟靛紅和三乙胺摩爾比為:(0.2-0.5):(0.2-0.5):1;
(3)溴代2-甲基色胺酮(5)的合成
在75-85攝氏度和氮氣保護的條件下,將步驟(2)所得的2-甲基色胺酮溶解於乾燥的二氯甲烷中,然後分批加入NBS和AIBN的混合物;反應液在75攝氏度加熱15-17小時,TLC檢測反應完全;反應液冷卻到室溫後經鹽水洗滌,無水硫酸鈉乾燥,濃縮得到的黃色產物;其中,2-甲基色胺酮和NBS和AIBN摩爾比為:1:1:(0.005-0.02);
(4)N-苄基色胺酮(1)的合成
將溴代2-甲基色胺酮、脂肪胺和三乙胺在乾燥DMF中於室溫下攪拌1.5-2.5小時,TLC檢測反應完全後,加入50毫升水,再用10毫升二氯甲烷萃取三次,合併的二氯甲烷相用水洗三次再用無水硫酸鈉乾燥;濃縮得到的黃色固體用矽膠分離,得到黃色的N-苄基色胺酮衍生物;其中,溴代2-甲基色胺酮和脂肪胺和三乙胺摩爾比為:1:(1-2):(2-5)。
3、一種如權利要求1所述的N-苄基色胺酮衍生物在製備預防和/或治療具有IDO介導的色氨酸代謝紊亂的病理學特徵的疾病的藥物中的套用。
實施方式
操作內容
下面通過實施例進一步說明《一種N-苄基色胺酮衍生物及其製備方法和套用》,但並不因此限制該發明的保護範圍。如無特別說明,以下實施例中所涉及到的試劑或原料均為市售。具體合成路線如下:
實施案例
實施例1:2-((二甲基氨基)甲基)-8-氟吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成,具體步驟如下:
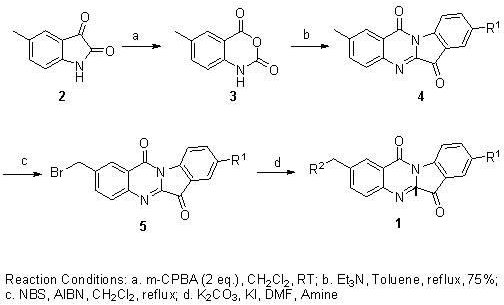
步驟(1)、6-甲基-1H-苯並[d][1,3]惡嗪-1,4-二酮(3)的合成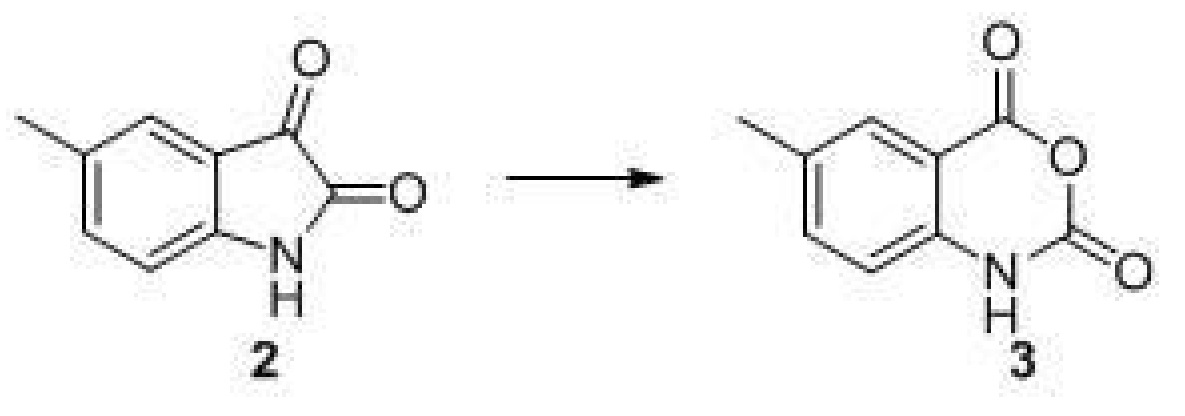

化合物2(500毫克,3毫摩爾)懸浮於10毫升的乾燥二氯甲烷中,在0攝氏度下分批加入間-氯過氧苯甲酸(1.3克,6毫摩爾,75%)。在室溫條件下攪拌2小時後。TLC檢測反應完全後,過濾反應形成的白色固體,然後用10毫升乙酸乙酯洗滌三次後,得到了化合物3(350毫克,65%)。
步驟(2)、8-氟-2-甲基吲哚並[2,1-b]喹唑啉-6,12-二酮(4)的合成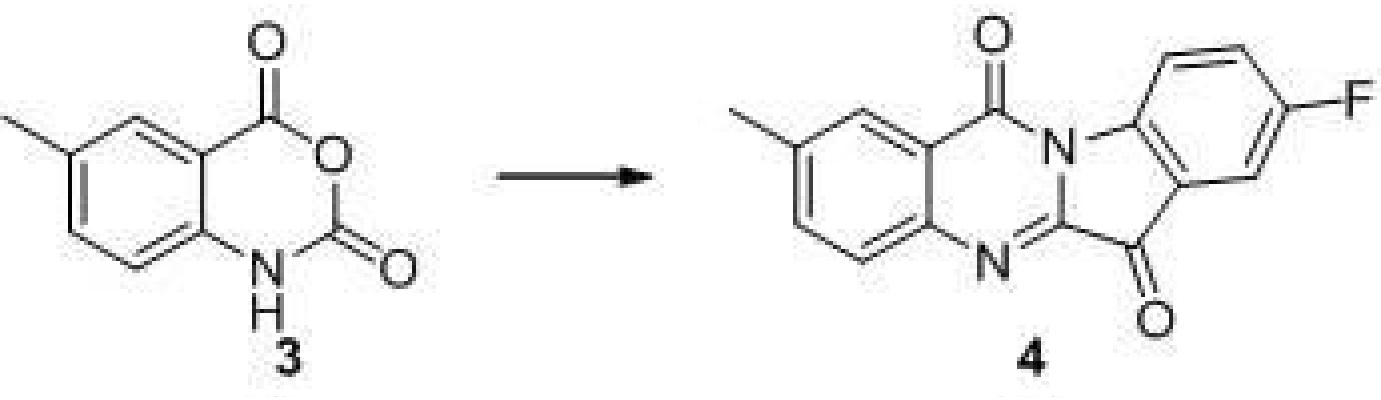

化合物3(1克,5.6毫摩爾),5-氟靛紅(0.93克,5.6毫摩爾)和三乙胺(1.5毫升,11.2毫摩爾)的混合物懸浮於乾燥的甲苯(10毫升)中,在110攝氏度下加熱4小時。減壓蒸去溶劑,所獲黃色固體溶於2毫升的二氯甲烷中,然後再加入2毫升乙酸乙酯,形成黃色固體經過濾,用2毫升乙酸乙酯洗滌三次,得到黃色固體化合物4(1.1克,75%)。
表征數據:H NMR(400 MHz,DMSO) δ8.50 (dd,J=8.8,4.2 Hz,1H),8.14(s,1H),7.86(d,J=8.2 Hz,1H),7.82–7.76(m,1H),7.76–7.67(m,1H),7.44–7.37(m,1H),2.53(s,3H).
步驟(3)、2-(溴甲基)8-氟吲哚[2,1-b]喹唑啉-6,12-二酮(5)的合成

在80攝氏度和氮氣保護的條件下,向化合物4(500毫克,1.78毫摩爾)的二氯甲烷(3.6毫升)溶液中分三批加入NBS(381毫克,2.14毫摩爾)和AIBN(29毫克,0.18毫摩爾)的混合物。反應液在80攝氏度加熱16小時。TLC檢測反應完全,反應液冷至室溫,鹽水洗滌,無水硫酸鈉乾燥,濃縮得到黃色產物5。
表征數據:H NMR(400 MHz,CDCl3) δ8.66(dd,J=8.8,4.0 Hz,1H),8.45(d,J=1.9 Hz,1H),8.04(d,J=8.3 Hz,1H),7.90(dd,J=8.3,2.1 Hz,1H),7.61(dd,J=6.5,2.6 Hz,1H),7.52(td,J=8.6,2.7 Hz,1H),4.65(s,2H)。
步驟(4)、2-((二甲基氨基)甲基)-8-氟吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成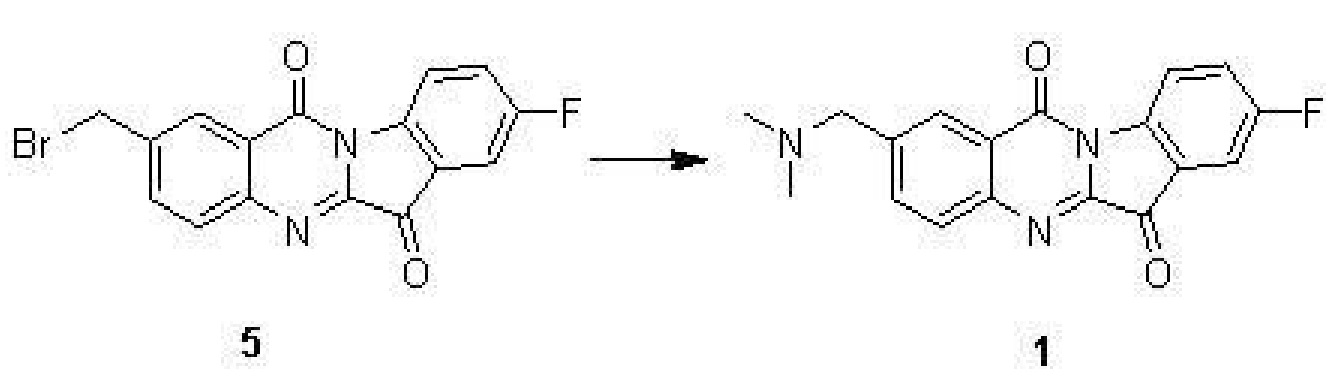

化合物5(500毫克,1.39毫摩爾),Dimethylamine hydrochloride(227毫克,2.78毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升的DMF中在室溫攪拌2小時。TLC檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次後,合併的有機相用水洗三次,再用無水硫酸鈉乾燥。濃縮得到的黃色固體用矽膠柱分離後得到黃色的化合物1。
表征數據:HNMR(400 MHz,CDCl3) δ8.63(dd,J=8.8,4.1 Hz,1H),8.33(d,J=1.5 Hz,1H),7.98(d,J=8.3 Hz,1H),7.87(dd,J=8.3,1.8 Hz,1H),7.58(dd,J=6.5,2.6 Hz,1H),7.48(td,J=8.7,2.7 Hz,1H),3.61(s,2H),2.30(s,6H)。
實施例2:
步驟(1)-步驟(3)同實施例1,
步驟(4):4(-(8-氟-6,12-二氧代-6,12-二羥基吲哚並[2,1-b]喹啉-2-基)甲基)哌嗪-1-甲酸叔丁酯(1)的合成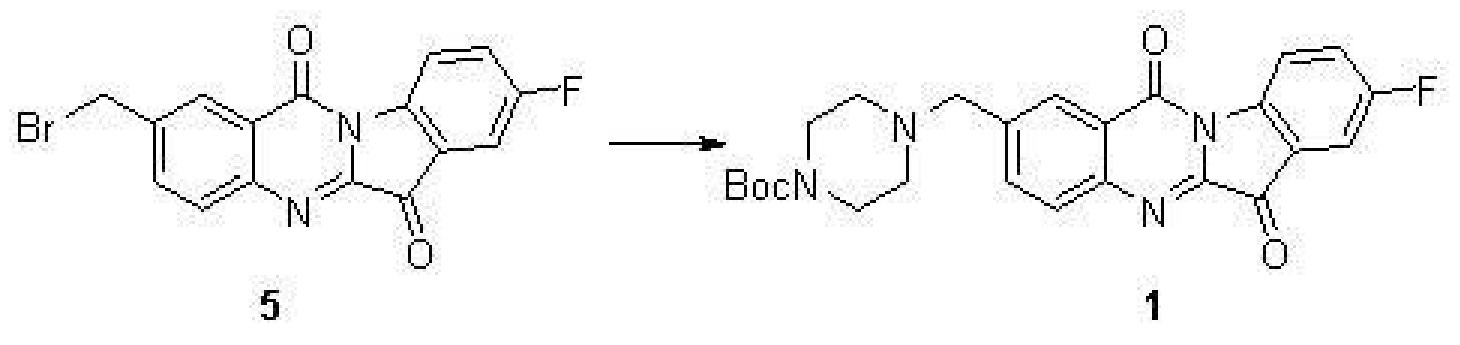

化合物5(500毫克,1.39毫摩爾),N-Bocpiperazine(546毫克,2.78毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升的DMF中於室溫攪拌2小時。TLC檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次,合併有機相用水洗三次,再用無水硫酸鈉乾燥。濃縮得到的黃色固體用矽膠柱分離後得到黃色化合物1。
表征數據:H NMR(400 MHz,CDCl3) δ8.66(dd,J=8.8,4.0 Hz,1H),8.39(d,J=1.5 Hz,1H),8.01(d,J=8.3 Hz,1H),7.90(dd,J=8.3,1.8 Hz,1H),7.60(dd,J=6.5,2.6 Hz,1H),7.51(td,J=8.6,2.7 Hz,1H),3.71(s,2H),3.47(m,4H),2.46(m,4H),1.48(s,9H)。
實施例3:8-氟-2-(哌嗪-1-基甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成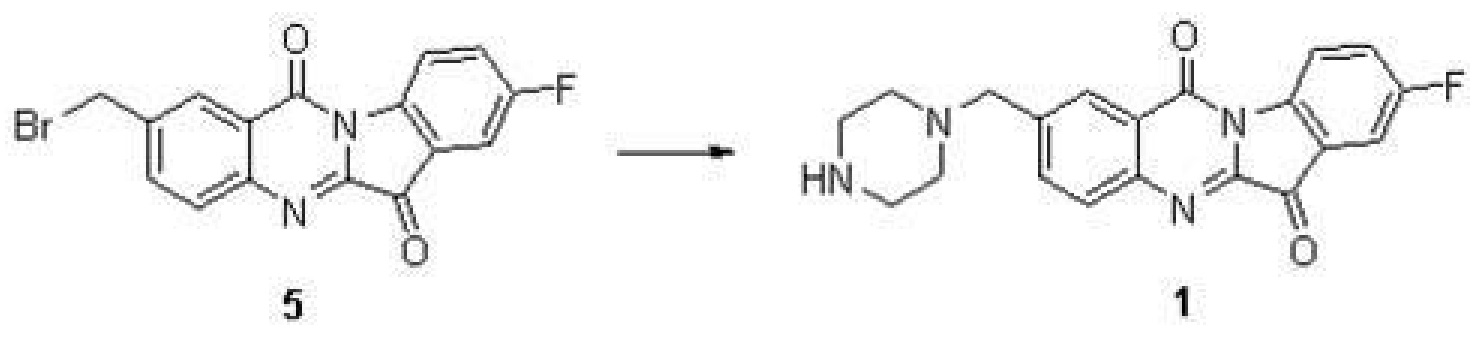

步驟(1)-步驟(3)同實施例1,
步驟(4):化合物5(500毫克,1.39毫摩爾),N-Bocpiperazine(546毫克,2.78毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升的DMF中於室溫攪拌2小時。TLC檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次,合併有機相用水洗三次,再用無水硫酸鈉乾燥。濃縮得到的黃色固體。將黃色固體溶解於3毫升的二氯甲烷中,在室溫條件下加入三氟乙酸1毫升。反應液在室溫攪拌1小時後,TLC(CH2Cl2/MeOH=10/1,Rf 0.2)檢測反應完全後,溶劑在減壓條件下去除,加入保護NaHCO3溶液10毫升,用乙酸乙酯(10毫升×3)萃取後,有機相用鹽水洗滌,乾燥,然後濃縮得到固體用矽膠柱分離得到黃色固體化合物1。
表征數據:H NMR(400 MHz,CDCl3) δ8.65(dd,J=8.8,4.0 Hz,1H),8.37(s,1H),8.00(d,J=8.3 Hz,1H),7.89(dd,J=8.3,1.6 Hz,1H),7.59(dd,J=6.5,2.6 Hz,1H),7.50(td,J=8.7,2.7 Hz,1H),3.70(s,2H),3.51–3.44(m,4H),2.46(s,4H)。
實施例4:8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成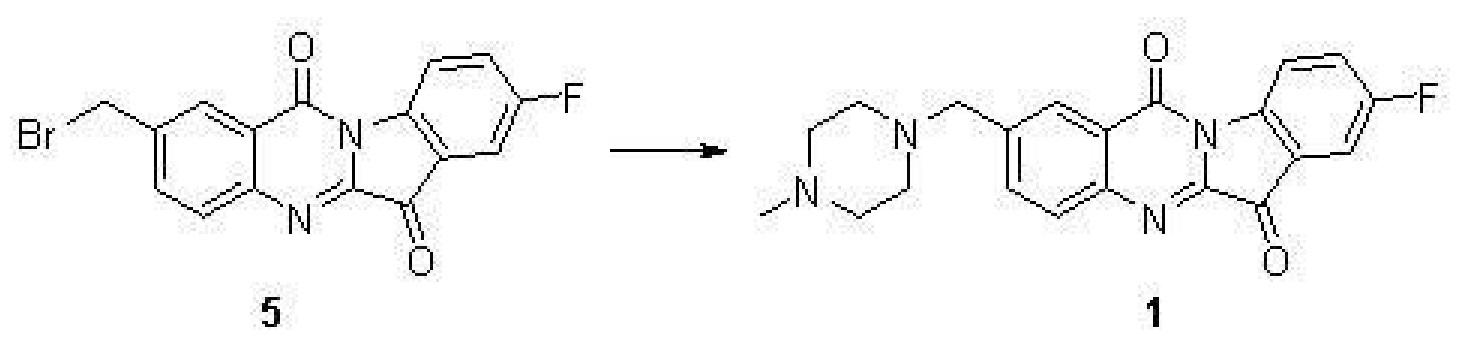

步驟(1)-步驟(3)同實施例1,
步驟(4):化合物5(220毫克,0.61毫摩爾),N-Methylpiperazine(122毫克,1.22毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升的DMF中在室溫攪拌2小時。TLC檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次,合併有機相用水洗三次,再用無水硫酸鈉乾燥。濃縮得到的黃色固體用矽膠柱分離後得到黃色化合物1。
表征數據:H NMR(400 MHz,CDCl3) δ8.65(dd,J=8.8,4.0 Hz,1H),8.38(d,J=1.5 Hz,1H),7.99(d,J=8.3 Hz,1H),7.87(dd,J=8.3,1.8 Hz,1H),7.59(dd,J=6.5,2.6 Hz,1H),7.50(td,J=8.7,2.7 Hz,1H),3.50(s,2H),2.59(s,8H),2.38(s,3H)。
實施例5:
步驟(1)-步驟(3)同實施例1,
步驟(4):8-氟-2-((嗎啡啉-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成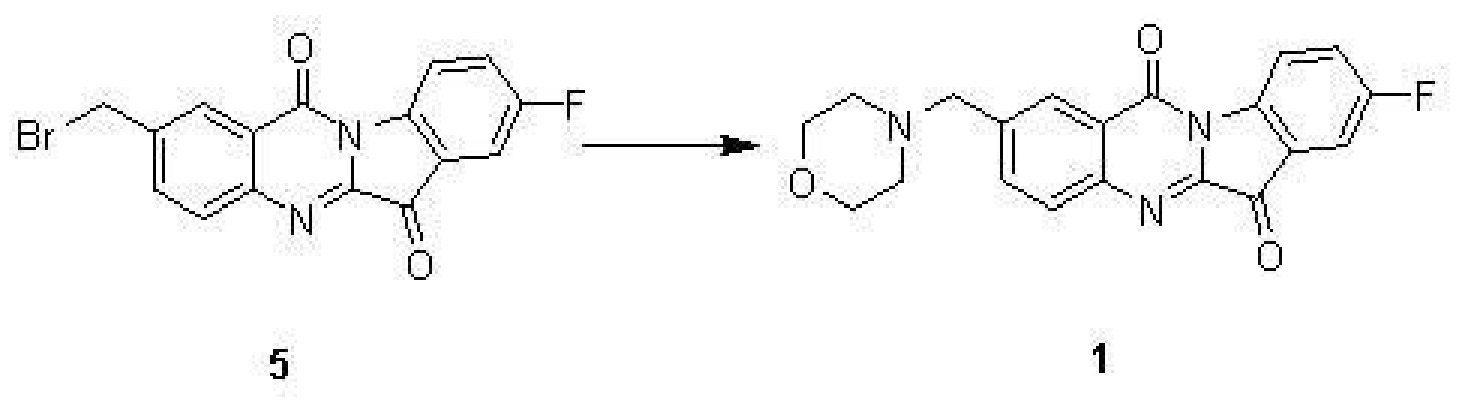

化合物5(500毫克,1.39毫摩爾),嗎啡啉(242毫克,2.78毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升DMF中在室溫攪拌2小時。TLC(EtOAc,Rf 0.5)檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次,合併有機相水洗三次,用無水硫酸鈉乾燥,濃縮得到黃色固體用矽膠柱(EtOAc)分離後得到黃色化合物1。
表征數據:H NMR(400 MHz,CDCl3) δ8.66(dd,J=8.8,4.1 Hz,1H),8.39(s,1H),8.01(d,J=8.3 Hz,1H),7.90(dd,J=8.3,1.7 Hz,1H),7.60(dd,J=6.5,2.7 Hz,1H),7.51(td,J=8.6,2.7 Hz,1H),3.79–3.73(m,4H),3.70(s,2H),2.52(s,4H)。
實施例6:
步驟(1)同實施例1,
步驟(2)、2-甲基吲哚[2,1-b]喹唑啉-6,12-二酮(4)的合成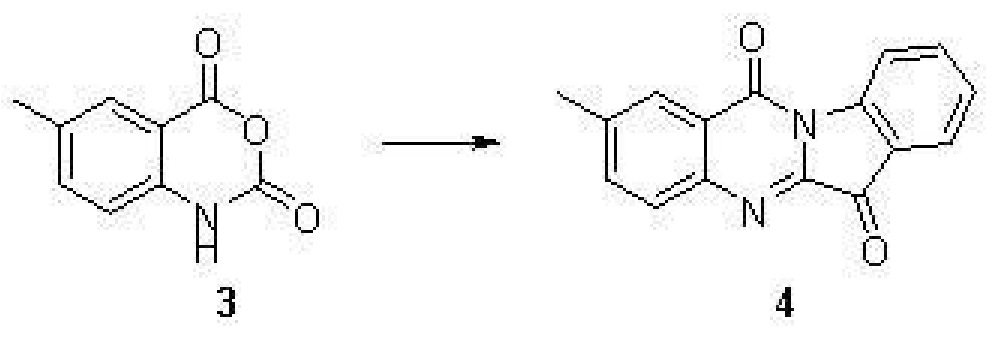

化合物3(1.7克,9.6毫摩爾),靛紅(1.4克,9.6毫摩爾)和三乙胺(2.7毫升,19.2毫摩爾)的混合物懸浮於乾燥的甲苯(18毫升)中,在110攝氏度下加熱4小時。反應液冷至室溫後,形成的黃色固體經過濾,用2毫升乙酸乙酯洗滌三次,得到黃色固體化合物4(0.5克,20%)。
表征數據:H NMR(400 MHz,CDCl3) δ8.65(d,J=8.1 Hz,1H),8.25(s,1H),7.94(dd,J=7.8,5.0 Hz,2H),7.85–7.75(m,1H),7.71–7.64(m,1H),7.44(t,J=7.5 Hz,1H),2.58(s,3H)。
步驟(3)、2-甲基吲哚[2,1-b]喹唑啉-6,12-二酮(5)的合成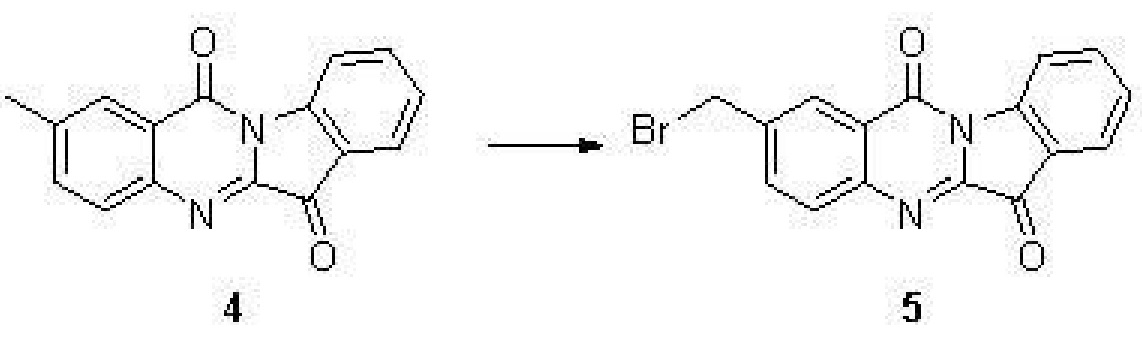

在80攝氏度和氮氣保護的條件下,向化合物4(262毫克,1.0毫摩爾)的二氯甲烷(5毫升)溶液中分三批加入NBS(381毫克,2.14毫摩爾)和AIBN(29毫克,0.18毫摩爾)的混合物。反應液冷卻到室溫,鹽水洗滌,無水硫酸鈉乾燥,濃縮後得到的黃色產物5(245毫克,91%)。
步驟(4)、2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(1)的合成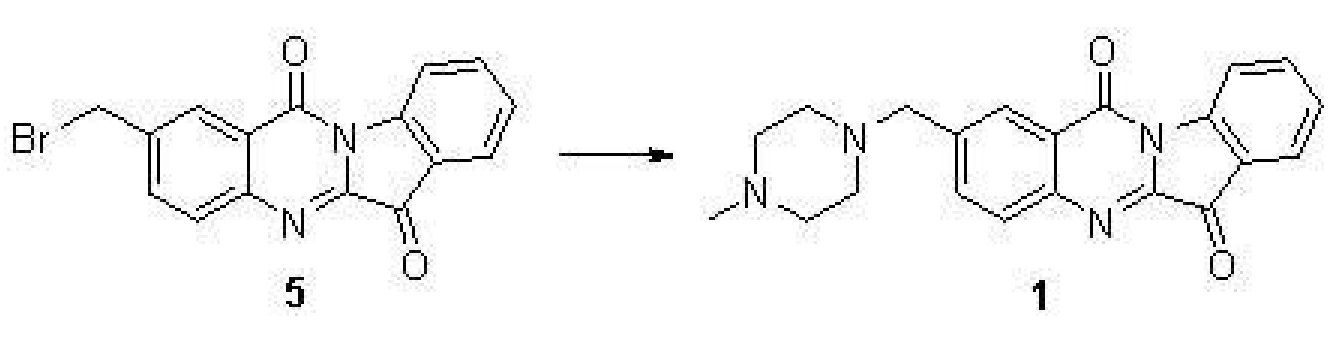

化合物5(220毫克,0.61毫摩爾),N-甲基哌啶(116毫克,1.616毫摩爾),碘化鉀(10毫克)和三乙胺(0.5毫升)在5毫升DMF中於室溫下攪拌2小時。TLC檢測反應完全後,加入50毫升水,用10毫升乙酸乙酯萃取三次,合併有機相用水洗三次,用無水硫酸鈉乾燥。濃縮得到的黃色固體用矽膠柱分離得到黃色化合物1(120毫克,55%)。
表征數據:H NMR(400 MHz,CDCl3) δ8.66(d,J=8.1 Hz,1H),8.39(s,1H),8.01(d,J=8.3 Hz,1H),7.94(d,J=7.5 Hz,1H),7.89(dd,J=8.2,1.7 Hz,1H),7.82(t,J=7.8 Hz,1H),7.45(t,J=7.5 Hz,1H),3.71(s,2H),2.71–2.41(m,8H),2.33(s,3H)。
實施例7:IDO抑制活性檢測
含人IDO基因的質粒的構建、在大腸桿菌中的表達、提取及純化均按Littlejohn等報導的方法進行(Takikawa O,Kuroiwa T,Yamazaki F,et al.J.Biol.Chem.1988,263,2041-2048)。各化合物對IDO的抑制活性按文獻介紹的方法檢測。在96孔板上將50毫摩爾/升磷酸鉀緩衝液(pH 6.5),40毫摩爾/升維生素C,400微克/毫升過氧化氫酶,20微摩爾/升亞甲基藍和IDO酶混合。向上述混合液內加入底物L-色氨酸和待測樣品。反應在37攝氏度下進行60分鐘,加入300克/升三氯乙酸使反應終止。96孔板在65攝氏度下加熱15分鐘,使之完成從甲醯犬尿氨酸到犬尿氨酸的轉化,然後6000相對離心力旋轉5分鐘。每孔取出100微升上清液轉移到新的96孔板內,加入20克/升對-(二甲基氨基)苯甲醛的乙酸溶液,犬尿氨酸與之反應產成的黃顏色可使用酶標儀在490納米觀測。
實施例8:是否為可逆抑制劑的判定
在固定抑制劑濃度的情況下,用一系列不同濃度的酶與抑制劑反應並測定反應速度。以反應速度對酶濃度(ν~[E])作圖,根據曲線的特徵可以判定是否是可逆抑制劑。
反應條件:在500微升的反應體系中,先加入50毫摩爾/升磷酸鉀緩衝液(pH 6.5),40毫摩爾/升維生素C,400微克/毫升過氧化氫酶,20微摩爾/升亞甲基藍,300毫摩爾/升底物L-色氨酸或同時加入100毫摩爾/升抑制劑,混合液37攝氏度保溫5分鐘,再向上述混合液內分別加入不同體積的IDO酶,反應在37攝氏度下進行30分鐘,加入300克/升三氯乙酸200微升使反應終止,反應體系在65攝氏度加熱15分鐘,使之完成從甲醯犬尿氨酸到犬尿氨酸的轉化,然後12000轉/分鐘旋轉10分鐘,取上清與等體積20克/升對-二甲氨基苯甲醛的乙酸溶液混合,用酶標儀檢測490納米波長讀數。以ν~[E]做圖。
實施例9:抑制劑類型判斷及Ki值測定
在500微升的反應體系中,先加入50毫摩爾/升磷酸鉀緩衝液(pH 6.5),40毫摩爾/升維生素C,400微克/毫升過氧化氫酶,20微摩爾/升亞甲基藍,分別加入100、250、300毫摩爾/升底物L-色氨酸,在一個底物濃度下,向各管反應體系中分別加入不同濃度的化合物,混合液37攝氏度保溫5分鐘,再向上述混合液內加入10微升IDO(約20納摩爾/升),反應在37攝氏度下進行30分鐘,加入300克/升三氯乙酸200微升使反應終止,反應體系在65攝氏度水浴加熱15分鐘,使之完成從甲醯犬尿氨酸到犬尿氨酸的轉化,然後12000轉/分鐘離心10分鐘,取上清與等體積20克/升對-二甲氨基苯甲醛的乙酸溶液混勻反應,用酶標儀檢測490納米波長讀數。以Dixon作圖法(1/v~[I])判定化合物的抑制劑類型,以S/v~[I]作圖,得到抑制劑的Ki值。
實施例10:半數有效抑制濃度IC50的測定
先將50毫摩爾/升磷酸鉀緩衝液(pH 6.5),40毫摩爾/升維生素C,400微克/毫升過氧化氫酶,20微摩爾/升亞甲基藍,底物L-色氨酸150毫摩爾/升和抑制劑混合。抑制劑濃度選用100,200,400,600,800,1000,1200微摩爾/升混合液37攝氏度保溫5分鐘,再向上述混合液內加入IDO酶。反應在37攝氏度下進行30分鐘,加入300克/升三氯乙酸200微升使反應終止,反應體系在65攝氏度加熱15分鐘,使之完成從甲醯犬尿氨酸到犬尿氨酸的轉化,然後12000轉/分鐘旋轉10分鐘,取200微升上清與等體積20克/升對-二甲氨基苯甲醛的乙酸溶液混合,犬尿氨酸與之反應產生的黃顏色可使用酶標儀在490納米檢測,所得結果利用IC50計算軟體計算。
利用上述方法,對N-苄基色胺酮衍生物(I)的IDO抑制活性進行測定,並用體內外實驗中通用的IDO抑制劑1-甲基色氨酸(1-MT,市售)作為對照物,各項指標如下。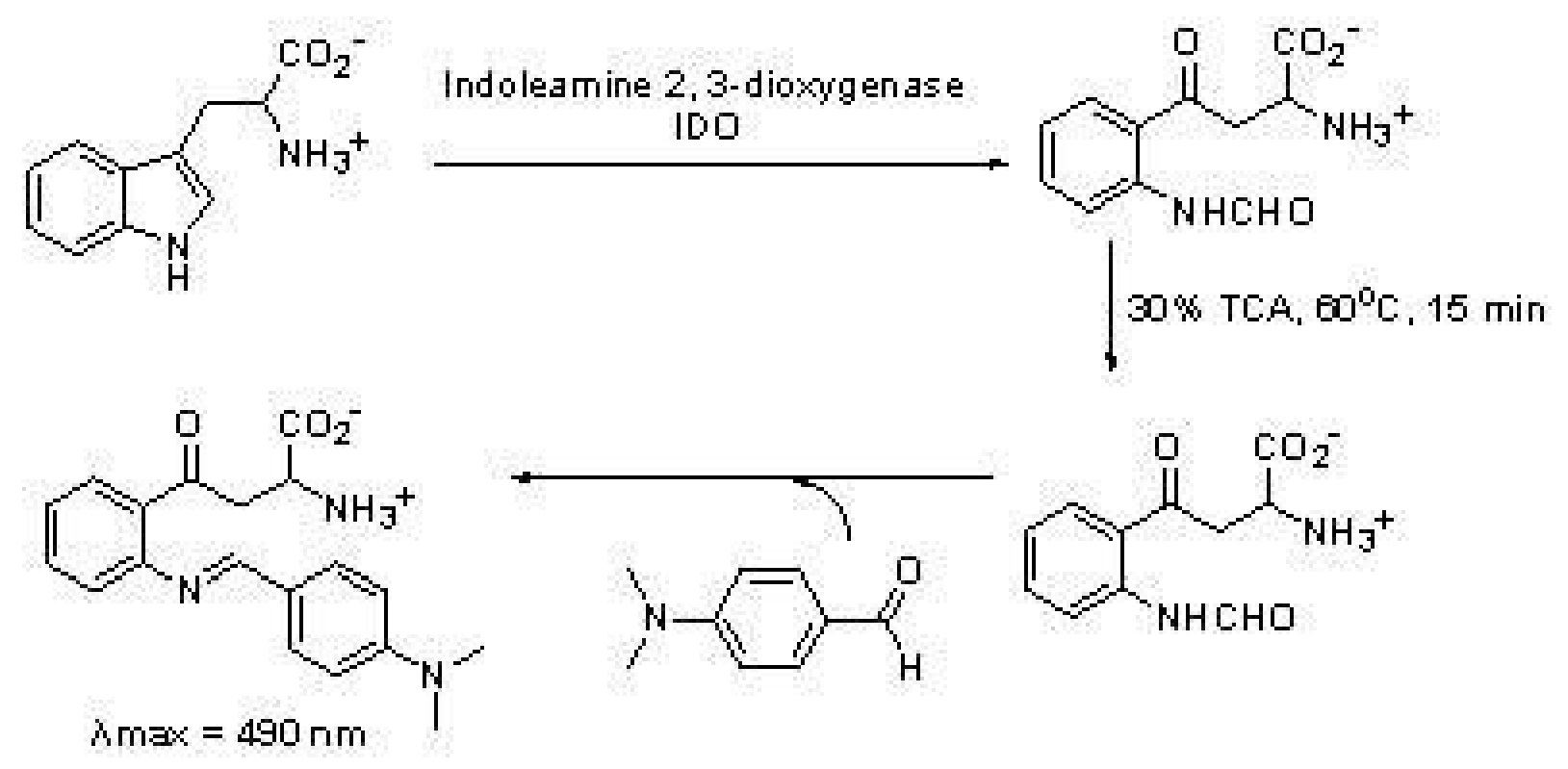

上述實施例中合成含N-苄基色胺酮衍生物(I)的IDO抑制活性如下:
化合物 | 抑制類型 | K1(微摩爾/升) | IC50(微摩爾/升,體外) |
|---|---|---|---|
1-MT | 競爭性 | 34 | 380 |
實施例1 | 反競爭性 | 0.31 | 0.11 |
實施例2 | 反競爭性 | 7.21 | 1.88 |
實施例3 | 非競爭性 | 4.12 | 0.68 |
實施例4 | 反競爭性 | 2.64 | 0.50 |
實施例5 | 反競爭性 | 0.47 | 0.40 |
實施例6 | 反競爭性 | 5.97 | 2.52 |
實施例11:8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(實施例4)抗腫瘤作用
1、Lewis腫瘤模型建立:健康雌性C57BL/6小鼠40隻,體重20±1克,購自上海斯萊克動物實驗中心,SPF級實驗室餵養。用無菌生理鹽水將Lewis肺癌細胞濃度為1×10/毫升細胞懸液。在無菌操作下在小鼠腋下皮下注射,每隻接種0.2毫升。
2、實驗分組:小鼠隨機分為4組,每組10隻。對照組給以等量0.5%羧甲基纖維素鈉,灌胃給藥;1-甲基色氨酸(1-MT)組,給藥量為200毫克/千克,灌胃給藥;8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮(1)組,給藥量為200毫克/千克,灌胃給藥。連續給藥7天接種腫瘤,之後繼續給藥18天並觀察腫瘤生長情況。停藥後次日斷頸處死小鼠,剝瘤稱重,液氮保存。
3、結果:小鼠經200毫克/千克的8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮預防給藥一周及接種後給藥治療,體內Lewis肺癌腫瘤的生長明顯受到抑制,直至給藥開始後第25天依然沒有明顯的腫瘤生成,而對照組於給藥後第11天發現腫瘤,1-MT組於給藥後第13天發生腫瘤。從腫瘤重量角度,8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮和1-MT的抑制率分別為82.8%和23.1%。8-氟-2-((4-甲基哌嗪-1-基)甲基)吲哚並[2,1-b]喹唑啉-6,12-二酮給藥組小鼠體重正常、皮毛有光澤、反應較靈活。
專利榮譽
2021年6月24日,《一種N-苄基色胺酮衍生物及其製備方法和套用》獲得第二十二屆中國專利銀獎。

