《一種9,9‑二苯基芴衍生物及其製備方法和套用》是長春海譜潤斯科技有限公司於2016年10月14日申請的專利,該專利的公布號為CN106632185A,授權公布日為2017年5月10日,發明人是周雯庭、郭建華。該發明涉及有機光電材料技術領域。
《一種9,9‑二苯基芴衍生物及其製備方法和套用》其通過最佳化分子結構設計,所得到的9,9‑二苯基芴衍生物具有更高的光取出效率,同時具有較好的空穴傳輸能力,可用於製備有機電致發光器件的光取出層和空穴傳輸層,尤其是作為有機電致發光器件中的光取出材料,能夠有效提高OLED器件的發光效率,優於2016年10月之前的常用OLED器件。該發明還提供一種9,9‑二苯基芴衍生物的製備方法,該製備方法簡單、原料易得。
2019年10月,《一種9,9‑二苯基芴衍生物及其製備方法和套用》獲得第三屆吉林省專利獎金獎。
基本介紹
- 中文名:一種9,9‑二苯基芴衍生物及其製備方法和套用
- 申請人:長春海譜潤斯科技有限公司
- 申請日:2016年10月14日
- 申請號:2016108983927
- 公布號:CN106632185A
- 公布日:2017年5月10日
- 發明人:周雯庭、郭建華
- 地址:吉林省長春市高新北區盛北大街3333號北湖科技園A5棟
- Int.Cl.:C07D307/91(2006.01)I、C09K11/06(2006.01)I、H01L51/50(2006.01)I、H01L51/54(2006.01)I
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,權利要求,實施方式,操作內容,實施案例,榮譽表彰,
專利背景
自1963年,美國紐約大學的Pope等首次觀察到了蒽的電致發光現象以來,有機電致發光技術得到了眾多科學研究者的不斷開發與改進,由最初製作的器件驅動電壓普遍較高,有機電致發光曾一度被認為沒有實用價值,到1987年,美國柯達公司的Tang等利用8-羥基喹啉鋁與具有空穴傳輸性能的芳香族二胺,採用超薄薄膜技術製備了在10V電壓下亮度為1000cd/m的綠光有機電致發光器件(organic light-emitting devices,OLEDs),取得了突破性進展,使得OLED的研究在世界範圍內得到了迅速廣泛的開展。在近30年的發展過程中,人們研製出了各種性能優良的OLED材料,並通過對器件結構的不同設計,和對器件壽命、效率等性能的最佳化,加快了OLED的商業化進程,使得OLED在顯示和照明領域得到了廣泛套用。
然而,OLED器件2016年前仍未得到普及化套用,其中最主要的因素之一就是器件的效率仍未達到理想水平。這是由於基板的模式損失、表面等離子的損失以及波導效應,使大部分的光被限制在發光器件內部,從而降低了器件的發光效率。改善器件的發光效率,利用光取出材料是行之有效的方法之一。光取出層(Capping Layer,CPL)通過降低金屬電極的表面電漿效應,調節出光方向和出光效率,能夠有效提高器件的光取出效率,從而提高器件的發光效率。2016年前光取出材料的種類較為單一,效果不盡理想,研發出較為有效的光取出材料是OLED工作者們面臨的較為嚴峻的挑戰之一。
發明內容
專利目的
《一種9,9‑二苯基芴衍生物及其製備方法和套用》的目的在於提供一種9,9-二苯基芴衍生物及其製備方法和套用。該發明所述9,9-二苯基芴衍生物不僅是一類光取出材料,而且具有空穴傳輸功能,可同時作為空穴傳輸層和光取出層,能夠有效提高器件的發光效率,並且大大節省了器件的製備成本。
技術方案
《一種9,9‑二苯基芴衍生物及其製備方法和套用》提供了一種9,9-二苯基芴衍生物,其特徵在於,結構式如式(I)所示:
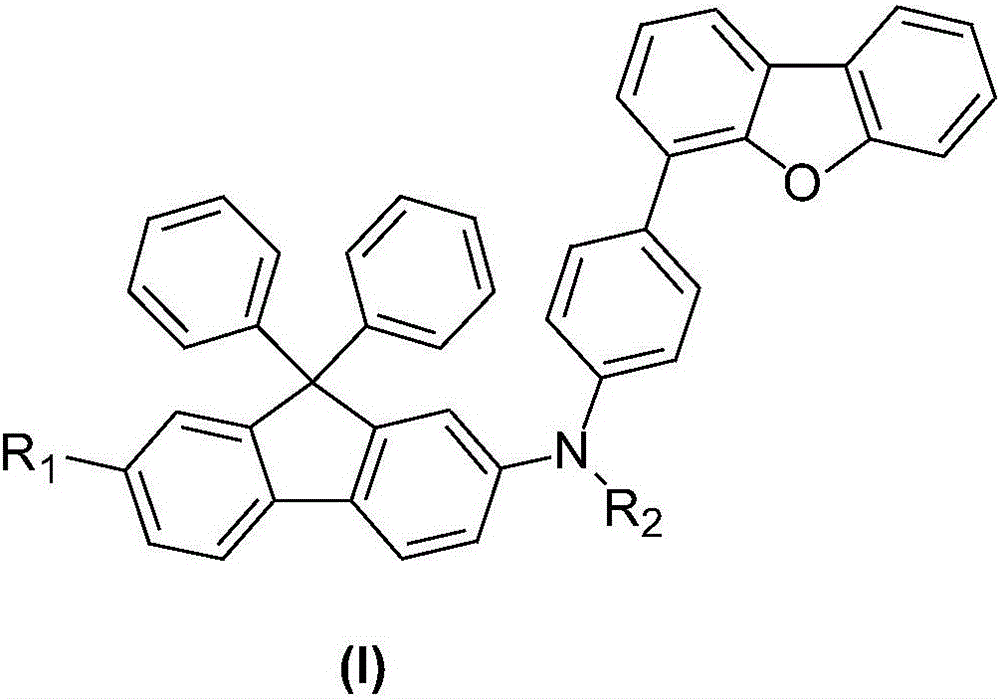
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
優選的,所述R1、R2獨立地選自取代或未取代的C6-C30的芳基、取代或未取代的C10-C30的稠芳基、取代或未取代的C5-C30的六元雜環或取代或未取代的C4-C30的五元雜環。
優選的,所述R1為取代或未取代的C6-C18的芳基或萘基,R2為取代或未取代的C6-C24的芳基或取代或未取代的C10-C29的稠芳基。
優選的,所述R1為苯基,R2為取代或未取代的C6-C24的芳基或取代或未取代的C10-C29的稠芳基。
更進一步優選的,所述9,9-二苯基芴衍生物為TM1-TM37所示結構中的任意一種:
該發明還提供一種9,9-二苯基芴衍生物的製備方法,包括:
將式(A)所示的中間體和式(B)所示的溴代芳烴在氬氣保護下反應得到式(Ⅰ)所示的9,9-二苯基芴衍生物:
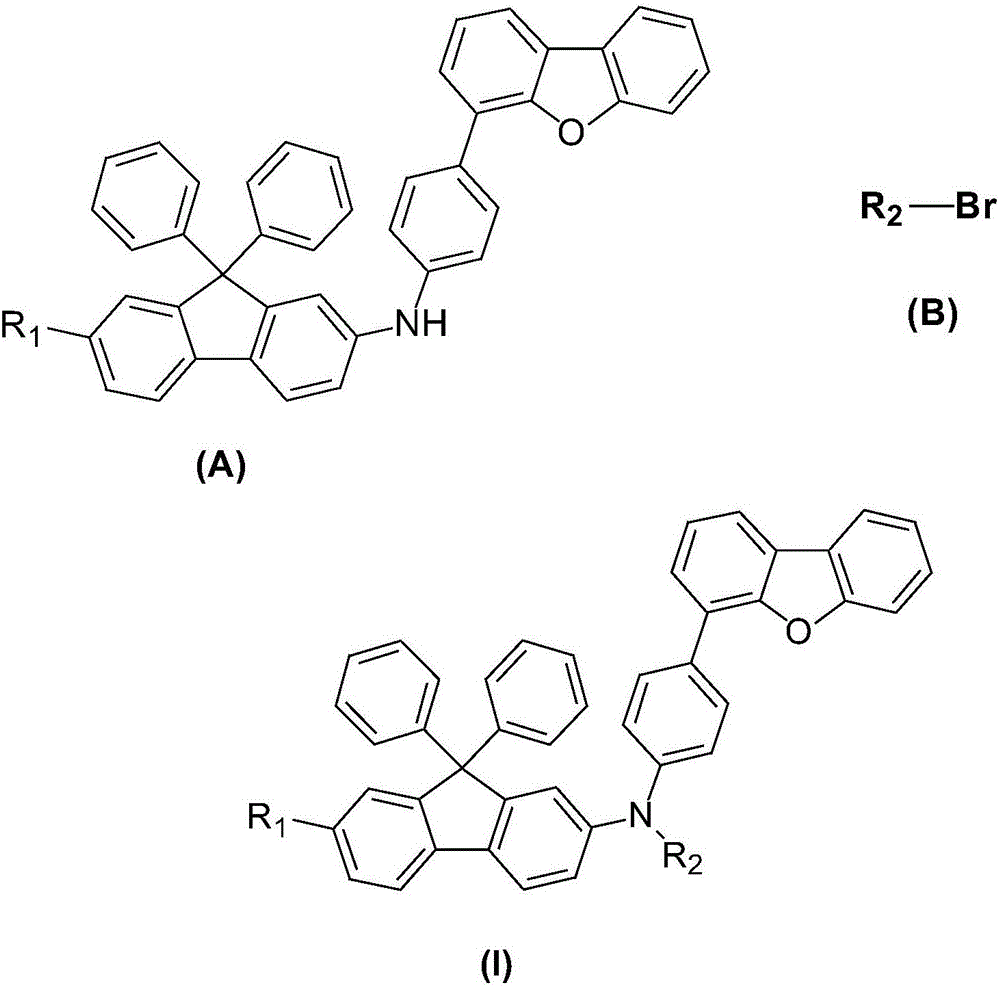
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
該發明還提供了上述9,9-二苯基芴衍生物在有機電致發光器件中的套用。
優選的,所述有機電致發光器件包括陽極、陰極、有機物層和光取出層;所述光取出層中含有所述的9,9-二苯基芴衍生物。
優選的,所述有機層中含有空穴傳輸層;光取出層和空穴傳輸層同時含有所述的9,9-二苯基芴衍生物。
該發明還提供一種顯示裝置,含有所述有機電致發光器件。
改善效果
《一種9,9‑二苯基芴衍生物及其製備方法和套用》該9,9-二苯基芴衍生物具有式(Ⅰ)所示結構,是帶隙較寬的有機材料,是較好的光取出材料。所述9,9-二苯基芴衍生物作為光取出材料可以改善半透射電極的透過率,降低金屬電極的表面電漿效應,同時調節出光方向和出光效率,提高OLED器件的外量子效率,從而能夠有效提高器件的發光效率,使可見光範圍內透過率達80%以上。所述9,9-二苯基芴衍生物均為芳香胺類化合物,具有較好的空穴傳輸功能,所以也可以套用到有機物層的空穴傳輸層上。將所述9,9-二苯基芴衍生物同時作為空穴傳輸層和光取出層套用於OLED器件中,不僅可以提高器件的發光效率,還能有效節約成本。
權利要求
1.一種9,9-二苯基芴衍生物,其特徵在於,結構式(I)如下所示:
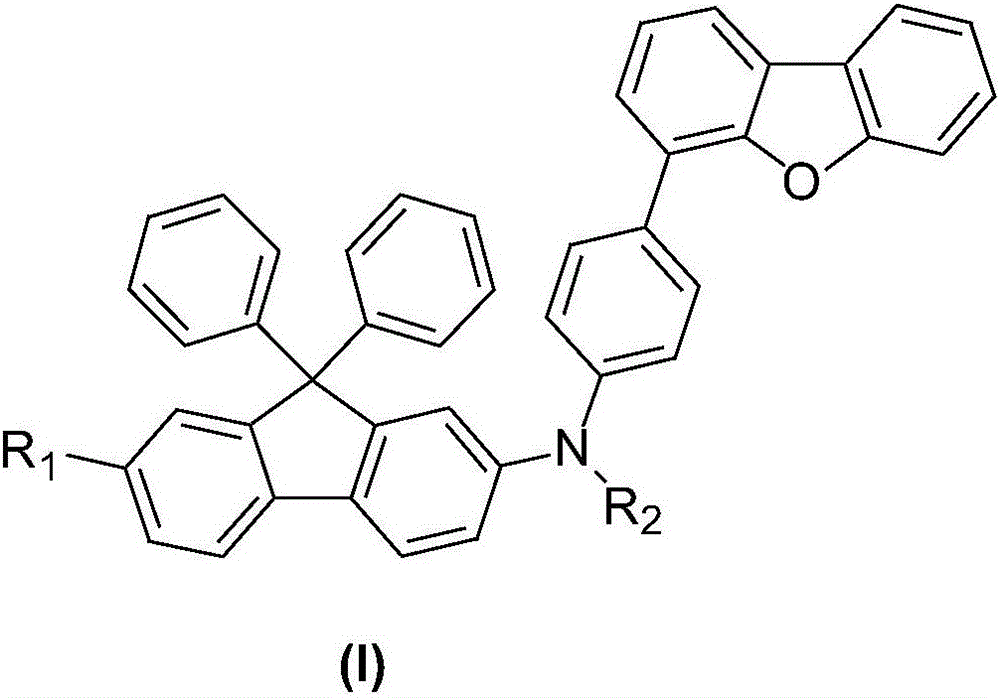
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
2.根據權利要求1所述的一種9,9-二苯基芴衍生物,其特徵在於,R1、R2獨立地選自取代或未取代的C6-C30的芳基、取代或未取代的C10-C30的稠芳基、取代或未取代的C5-C30的六元雜環或取代或未取代的C4-C30的五元雜環。
3.根據權利要求1所述的一種9,9-二苯基芴衍生物,其特徵在於,R1為取代或未取代的C6-C18的芳基或萘基,R2為取代或未取代的C6-C24的芳基或取代或未取代的C10-C29的稠芳基。
4.根據權利要求1所述的一種9,9-二苯基芴衍生物,其特徵在於R1為苯基,R2為取代或未取代的C6-C24的芳基或取代或未取代的C10-C29的稠芳基。
5.根據權利要求1所述的一種9,9-二苯基芴衍生物,其特徵在於,所述的9,9-二苯基芴衍生物為化合物TM1-TM37中的任意一種:
6.權利要求1-5任一項所述的9,9-二苯基芴衍生物的製備方法,其特徵在於,包括:將式(A)所示的中間體和式(B)所示的溴代芳烴在氬氣保護下反應得到式(Ⅰ)所示的9,9-二苯基芴衍生物:
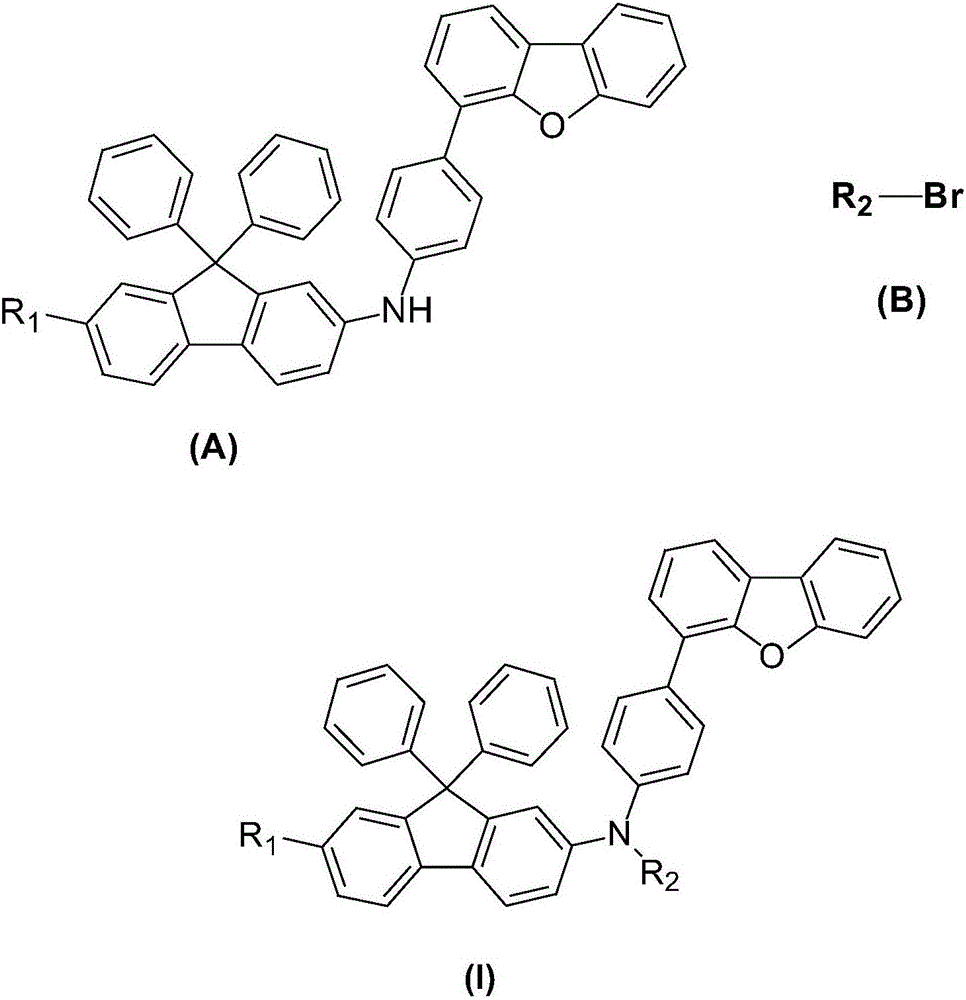
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
7.權利要求1-5任意一項所述的9,9-二苯基芴衍生物在有機電致發光器件中的套用。
8.根據權利要求7所述的9,9-二苯基芴衍生物在有機電致發光器件中的套用,其特徵在於,所述有機電致發光器件包括陽極、陰極、有機物層和光取出層;所述光取出層中含有權利要求1-5任一項所述的9,9-二苯基芴衍生物。
9.根據權利要求8所述的9,9-二苯基芴衍生物在有機電致發光器件中的套用,其特徵在於,所述有機層中含有空穴傳輸層;所述光取出層和空穴傳輸層中同時含有權利要求1-5任一項所述的9,9-二苯基芴衍生物。
10.一種顯示裝置,其特徵在於,包括權利要求7-9中任一項所述的有機電致發光器件。
實施方式
操作內容
《一種9,9‑二苯基芴衍生物及其製備方法和套用》首先提供一種9,9-二苯基芴衍生物,結構式為:
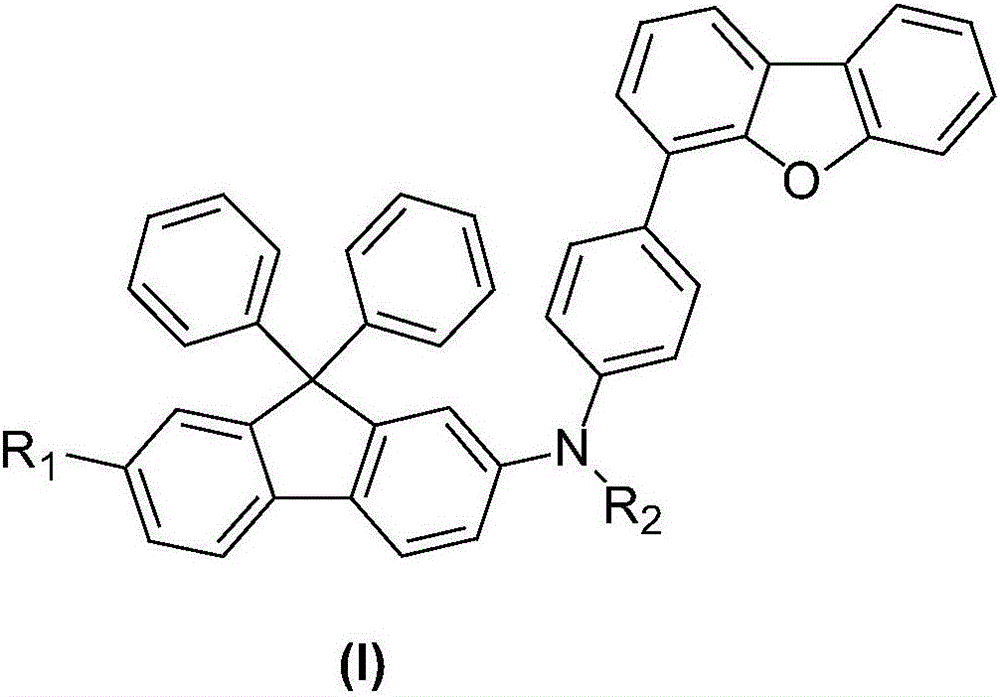
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
優選的,R1、R2獨立地選自取代或未取代的C6-C30的芳基、取代或未取代的C10-C30的稠芳基、取代或未取代的C5-C30的六元雜環或取代或未取代的C4-C30的五元雜環。
優選的,R1為取代或未取代的C6-C18的芳基或萘基,R2為取代或未取代的C6-C24的芳基或取代或未取代的C10-C29的稠芳基;
可選的,R1結構如下:
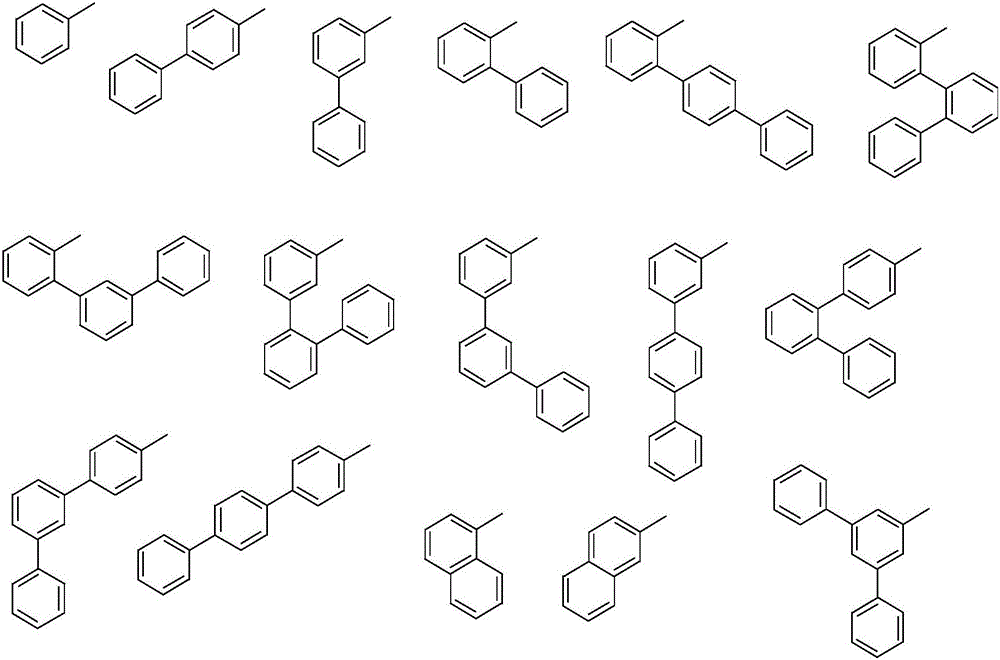
可選的,R2結構如下:
具體的,所述9,9-二苯基芴衍生物優選選自如下TM1-TM37所示結構中的任意一種:
該發明還提供了所述9,9-二苯基芴衍生物的製備方法,包括:
將式(A)所示的中間體和式(B)所示的溴代芳烴在氬氣保護下反應得到式(Ⅰ)所示的9,9-二苯基芴衍生物:
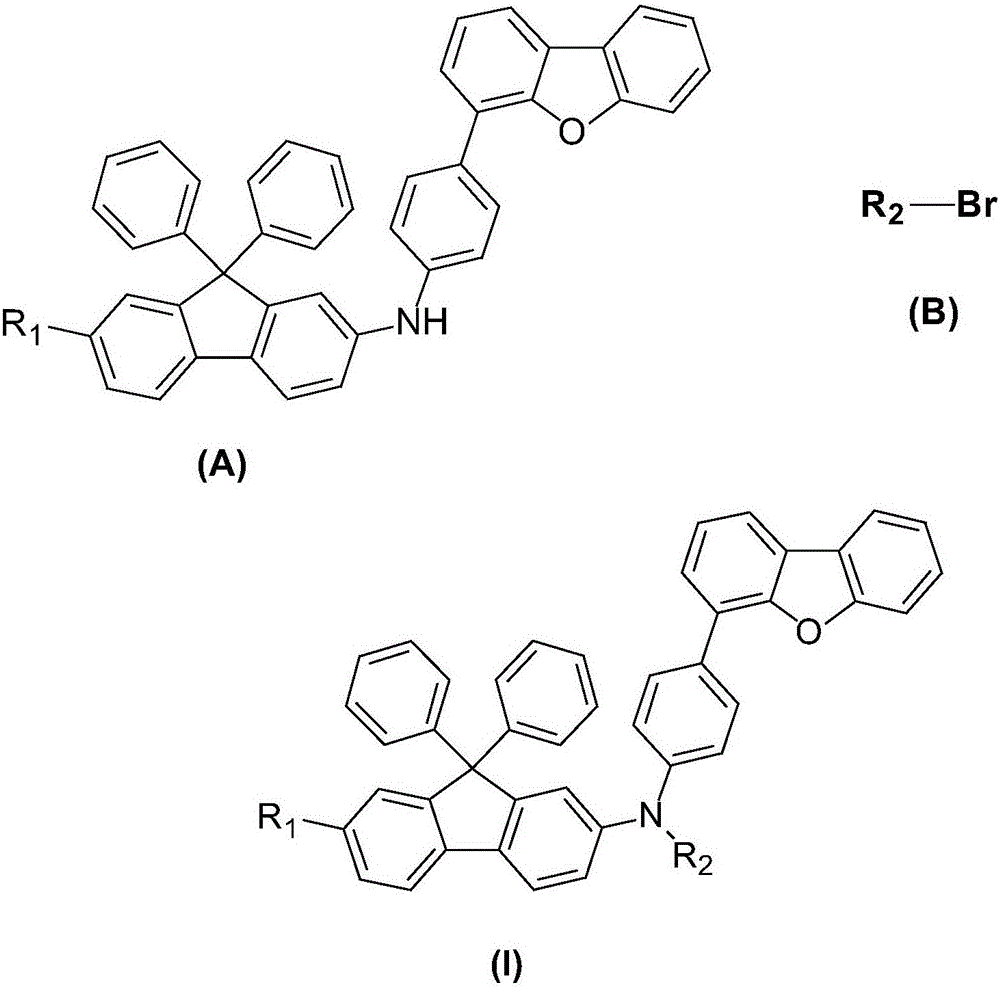
其中,R1、R2獨立地選自取代或未取代的C6-C60的芳基、取代或未取代的C10-C60的稠芳基、取代或未取代的C5-C60的六元雜環或取代或未取代的C4-C60的五元雜環。
按照該發明,式(A)所示的中間體按照如下所示方法製備得到:
(1)將2-溴-9,9-二苯基芴與硼酸化合物(R1-B(OH)2)在催化劑的作用下發生反應,得到中間體1;
(2)將二苯並呋喃-4-硼酸與4’-溴乙醯苯胺在催化劑的作用下發生反應,得到中間體2;
(3)將中間體1和中間體2在催化劑的作用下發生反應,得到中間體(A)。
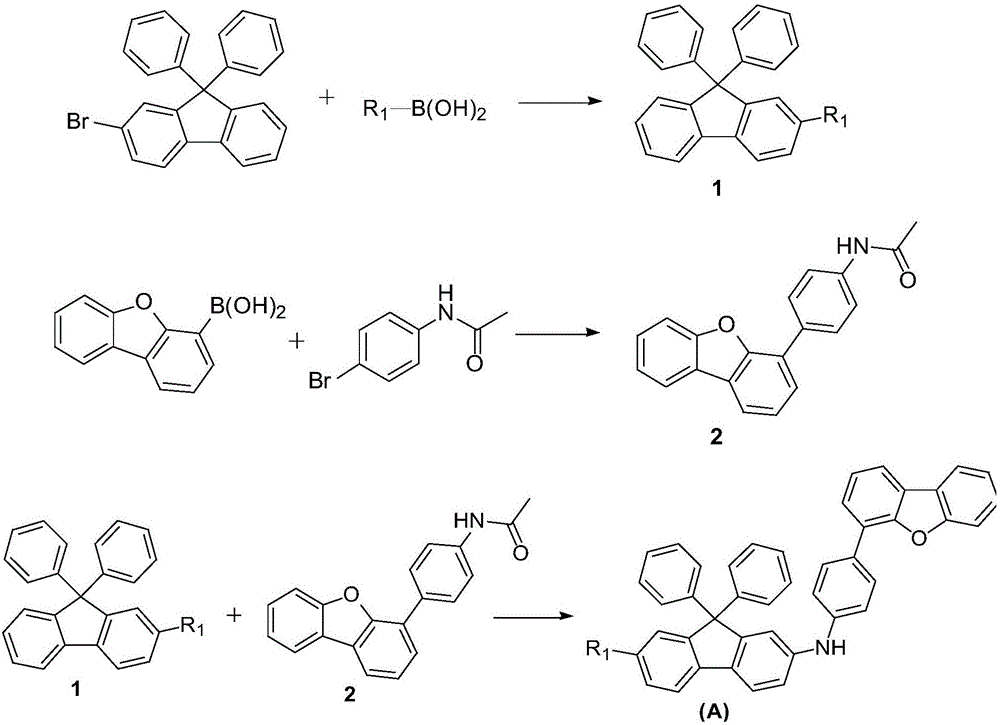
該發明對上述方法的反應條件沒有特別的限制,採用該領域技術人員所熟知的反應條件即可。
按照該發明,將式(A)所示的中間體和式(B)所示的溴代芳烴在氬氣保護下反應得到式(Ⅰ)所示的9,9-二苯基芴衍生物,該發明對所述反應沒有特殊的限制,採用該領域技術人員所熟知的反應即可,該製備方法簡單,原料易得。
該發明進一步提供了所述的9,9-二苯基芴衍生物在有機電致發光器件中的套用。優選所述的有機電致發光器件包括陽極、陰極、有機物層和光取出層,所述光取出層中含有所述的9,9-二苯基芴衍生物;所述有機物層優選包含空穴注入層、空穴傳輸層、電子阻擋層、發光層、空穴阻擋層、電子傳輸層、電子注入層中的至少一層;更優選所述有機層中含有空穴傳輸層,所述光取出層和空穴傳輸層同時含有所述的9,9-二苯基芴衍生物。
採用的器件結構優選的,具體為:以ITO透明玻璃作為陽極;NPB或所述9,9-二苯基芴衍生物(TM1-TM37中的任意一種)作為空穴傳輸層;TCTA作為發光層,或作為主體同磷光材料摻雜(摻雜的質量濃度為0.5~30.0%)作為發光層;TPBI作為電子傳輸層;以Al層作為陰極;最後將所述的9,9-二苯基芴衍生物(TM1-TM37中的任意一種)蒸鍍在上述陰極上,作為光取出層。上述器件採用了該發明所述的9,9-二苯基芴衍生物(TM1-TM37中的任意一種)作為光取出層或同時作為光取出層和空穴傳輸層,較傳統器件發光效率得到了顯著提高:上述器件的發光效率在46cd/A~60cd/A之間,傳統器件的發光效率為30cd/A。
所述有機電致發光器件可用於平板顯示器、照明光源、指示牌、信號燈等套用領域。該發明更進一步提供了一種顯示裝置,包括所述的有機電致發光器件。
實施案例
實施例1:中間體A的製備
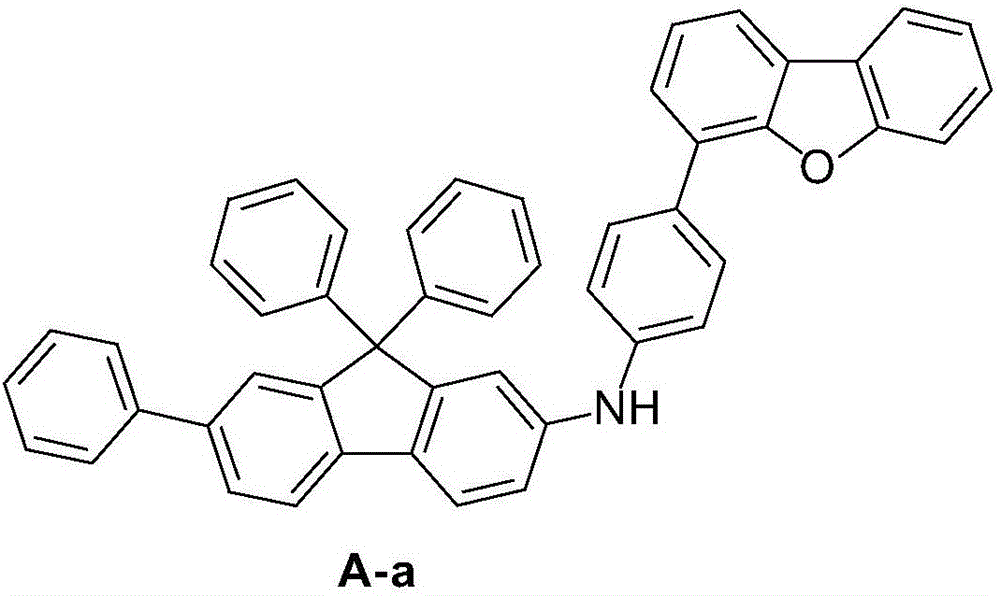
根據R1選取的不同,中間體A的結構不同,當R1為苯基時中間體的結構如式A-a所示:
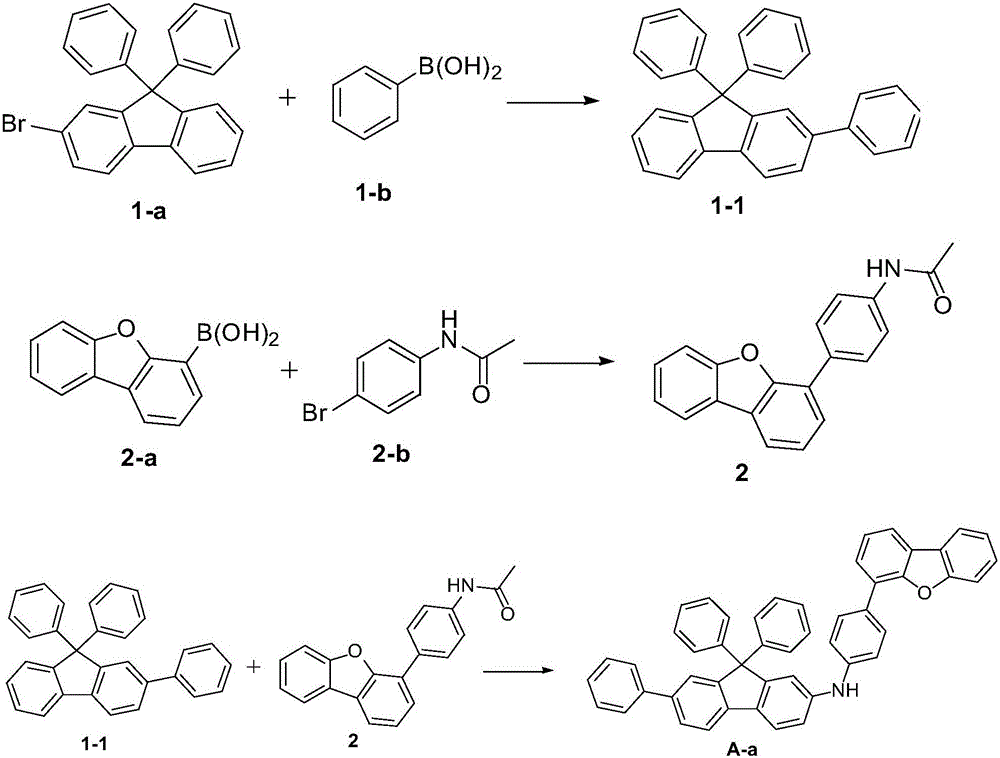
(1)中間體1-1的合成:向三口燒瓶中加入23克(58毫摩爾)的2-溴-9,9-二苯基芴(化合物1-a),10.6克(87毫摩爾)苯硼酸,4.1克(5.8毫摩爾)的雙三苯基膦二氯化鈀、150毫升的2M碳酸鈉水溶液、300毫升的甲苯和100毫升的乙醇,將反應體系升溫至100℃,攪拌反應12小時。冷卻至室溫,然後用二氯甲烷(200毫升)萃取,有機相用蒸餾水(150毫升)洗滌,然後用硫酸鎂乾燥,並減壓蒸餾。柱層析(正己烷:二氯甲烷為20:1)獲得中間體1-1(10.7克27毫摩爾)。
(2)中間體2的合成:在氬氣氛下,向9.6克(45毫摩爾)的4’-溴乙醯苯胺、11.4克(54毫摩爾)的二苯並呋喃-4-硼酸、1克(0.9毫摩爾)的四(三苯基膦)鈀中加入180摩爾甲苯、40毫升二甲氧基乙烷、44毫升(88.4毫摩爾)的2M碳酸鈉水溶液,加熱回流攪拌10小時。反應結束後,冷卻至室溫,有晶體析出,過濾,晶體溶於四氫呋喃,用硅藻土/矽膠過濾,減壓蒸餾,所得殘渣用甲醇/己烷洗滌,然後乾燥,得到5.1克(24毫摩爾)的中間體2。
(3)中間體A-a的合成:在氬氣氛下,向9.5克(24毫摩爾)的中間體1-1、5.1克(24毫摩爾)的中間體2和4.6克(48毫摩爾)的叔丁醇鈉中加入120毫升的脫水甲苯。然後繼續在氬氣氛下邊攪拌邊加入0.1克(0.48毫摩爾)三叔丁基膦和0.11克(0.48毫摩爾)的醋酸鈀,加熱至80℃,反應8小時。冷卻後,用硅藻土/矽膠進行過濾,通過減壓蒸餾濃縮濾液,將得到的殘渣在甲苯中重結晶,過濾,乾燥,得到12.5克(19.2毫摩爾)的中間體A-a(產率80%)。
實施例2:化合物TM1的合成
在氬氣氛下,向651毫克(1毫摩爾)的中間體A-a、157毫克(1毫摩爾)的溴苯、14毫克(0.015毫摩爾)的三(二亞苄基丙酮)二鈀、8.7毫克(0.03毫摩爾)的四氟硼酸三叔丁基膦和190毫克(2毫摩爾)的叔丁醇鈉中加入5毫升無水二甲苯,加熱回流8小時。反應結束後,將體系冷卻至50℃,用硅藻土/矽膠過濾,將濾液濃縮。所得殘渣通過柱層析法純化,將所得固體在甲苯中重結晶,得到386毫克(0.53毫摩爾)的化合物TM1(產率為53%)。質譜m/z:727.93(計算值:727.89)。理論元素含量(%)C55H37NO:C,90.75;H,5.12;N,1.92;O,2.20。實測元素含量(%):C,90.73;H,5.06;N,1.88;O,2.14。上述結果證實獲得產物為目標產品。
實施例3:化合物TM2的合成
將實施例2中的溴苯替換為等摩爾的4-溴代聯苯,其他步驟均與實施例2相同,得到化合物TM2。質譜m/z:803.85(計算值:803.98)。理論元素含量(%)C61H41NO:C,91.13;H,5.14;N,1.74;O,1.99。實測元素含量(%):C,91.04;H,5.06;N,1.68;O,1.85。上述結果證實獲得產物為目標產品。
實施例4:化合物TM3的合成
將實施例2中的溴苯替換為等摩爾的3-溴聯苯,其他步驟均與實施例2相同,得到化合物TM3。質譜m/z:803.99(計算值:803.98)。理論元素含量(%)C61H41NO:C,91.04;H,5.03;N,1.66;O,1.87。實測元素含量(%):C,91.13;H,5.14;N,1.74;O,1.99。上述結果證實獲得產物為目標產品。
實施例5:化合物TM4的合成
將實施例2中的溴苯替換為等摩爾的2-溴聯苯,其他步驟均與實施例2相同,得到化合物TM4。質譜m/z:803.99(計算值:803.98)。理論元素含量(%)C61H41NO:C,91.04;H,5.03;N,1.66;O,1.87。實測元素含量(%):C,91.06;H,5.01;N,1.63;O,1.89。上述結果證實獲得產物為目標產品。
實施例6:化合物TM5的合成
將實施例2中的溴苯替換為等摩爾的4-溴對三聯苯,其他步驟均與實施例2相同,得到化合物TM5。質譜m/z:880.15(計算值:880.08)。理論元素含量(%)C67H45NO:C,91.44;H,5.15;N,1.59;O,1.82。實測元素含量(%):C,91.36;H,5.03;N,1.47;O,1.74。上述結果證實獲得產物為目標產品。
實施例7:化合物TM6的合成
將實施例2中的溴苯替換為等摩爾的1-溴-3,5-二苯基苯,其他步驟均與實施例2相同,得到化合物TM6。質譜m/z:880.12(計算值:880.08)。理論元素含量(%)C67H45NO:C,91.44;H,5.15;N,1.59;O,1.82。實測元素含量(%):C,91.35;H,5.08;N,1.43;O,1.77。上述結果證實獲得產物為目標產品。
實施例8:化合物TM7的合成
將實施例2中的溴苯替換為等摩爾的4-溴間三聯苯,其他步驟均與實施例2相同,得到化合物TM7。質譜m/z:880.12(計算值:880.08)。理論元素含量(%)C67H45NO:C,91.44;H,5.15;N,1.59;O,1.82。實測元素含量(%):C,91.33;H,5.04;N,1.47;O,1.75。上述結果證實獲得產物為目標產品。
實施例9:化合物TM8的合成
將實施例2中的溴苯替換為等摩爾的3-溴-1,1’:4’,1”-三聯苯,其他步驟均與實施例2相同,得到化合物TM8。質譜m/z:880.12(計算值:880.08)。理論元素含量(%)C67H45NO:C,91.44;H,5.15;N,1.59;O,1.82。實測元素含量(%):C,91.31;H,5.08;N,1.39;O,1.79。上述結果證實獲得產物為目標產品。
實施例10:化合物TM9的合成
將實施例2中的溴苯替換為等摩爾的2-溴-1,1’:4’,1”-三聯苯,其他步驟均與實施例2相同,得到化合物TM9。質譜m/z:880.12(計算值:880.08)。理論元素含量(%)C67H45NO:C,91.44;H,5.15;N,1.59;O,1.82。實測元素含量(%):C,91.33;H,5.04;N,1.43;O,1.74。上述結果證實獲得產物為目標產品。
實施例11:化合物TM10的合成
將實施例2中的溴苯替換為等摩爾的1-(4-溴苯基)-3,5-二苯基苯,其他步驟均與實施例2相同,得到化合物TM10。質譜m/z:956.22(計算值:956.18)。理論元素含量(%)C73H49NO:C,91.70;H,5.17;N,1.46;O,1.67。實測元素含量(%):C,91.65;H,5.13;N,1.34;O,1.61。上述結果證實獲得產物為目標產品。
實施例12:化合物TM11的合成
將實施例2中的溴苯替換為等摩爾的4-溴-1,1':3',1”:3”,1”'-聯四苯,其他步驟均與實施例2相同,得到化合物TM11。質譜m/z:956.22(計算值:956.18)。理論元素含量(%)C73H49NO:C,91.70;H,5.17;N,1.46;O,1.67。實測元素含量(%):C,91.64;H,5.08;N,1.38;O,1.57。上述結果證實獲得產物為目標產品。
實施例13:化合物TM12的合成
將實施例2中的溴苯替換為等摩爾的1-溴代萘,其他步驟均與實施例2相同,得到化合物TM12。質譜m/z:777.96(計算值:777.95)。理論元素含量(%)C59H39NO:C,91.09;H,5.05;N,1.80;O,2.06。實測元素含量(%):C,91.04;H,4.93;N,1.64;O,1.96。上述結果證實獲得產物為目標產品。
實施例14:化合物TM13的合成
將實施例2中的溴苯替換為等摩爾的2-溴代萘,其他步驟均與實施例2相同,得到化合物TM13。質譜m/z:777.96(計算值:777.95)。理論元素含量(%)C59H39NO:C,91.09;H,5.05;N,1.80;O,2.06。實測元素含量(%):C,91.03;H,4.95;N,1.74;O,1.98。上述結果證實獲得產物為目標產品。
實施例15:化合物TM14的合成
將實施例2中的溴苯替換為等摩爾的2-(4-溴苯基)萘,其他步驟均與實施例2相同,得到化合物TM14。質譜m/z:854.12(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.33;H,5.05;N,1.54;O,1.73。上述結果證實獲得產物為目標產品。
實施例16:化合物TM15的合成
將實施例2中的溴苯替換為等摩爾的1-(4-溴苯基)萘,其他步驟均與實施例2相同,得到化合物TM15。質譜m/z:854.12(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.37;H,4.99;N,1.57;O,1.71。上述結果證實獲得產物為目標產品。
實施例17:化合物TM16的合成
將實施例2中的溴苯替換為等摩爾的2-溴-7-苯基萘,其他步驟均與實施例2相同,得到化合物TM16。質譜m/z:854.12(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.35;H,4.98;N,1.53;O,1.75。上述結果證實獲得產物為目標產品。
實施例18:化合物TM17的合成
將實施例2中的溴苯替換為等摩爾的1-溴-4-苯基萘,其他步驟均與實施例2相同,得到化合物TM17。質譜m/z:854.12(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.36;H,4.96;N,1.54;O,1.77。上述結果證實獲得產物為目標產品。
實施例19:化合物TM18的合成
將實施例2中的溴苯替換為等摩爾的1-溴-2-苯基萘,其他步驟均與實施例2相同,得到化合物TM18。質譜m/z:854.15(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.34;H,4.97;N,1.56;O,1.75。上述結果證實獲得產物為目標產品。
實施例20:化合物TM19的合成
將實施例2中的溴苯替換為等摩爾的1-溴-5-苯基萘,其他步驟均與實施例2相同,得到化合物TM19。質譜m/z:854.11(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.36;H,4.96;N,1.51;O,1.79。上述結果證實獲得產物為目標產品。
實施例21:化合物TM20的合成
將實施例2中的溴苯替換為等摩爾的3-溴-1-苯基萘,其他步驟均與實施例2相同,得到化合物TM20。質譜m/z:854.15(計算值:854.04)。理論元素含量(%)C65H43NO:C,91.41;H,5.07;N,1.64;O,1.87。實測元素含量(%):C,91.33;H,4.94;N,1.53;O,1.78。上述結果證實獲得產物為目標產品。
實施例22:化合物TM21的合成
將實施例2中的溴苯替換為等摩爾的4-溴-1,2’-聯二萘,其他步驟均與實施例2相同,得到化合物TM21。質譜m/z:904.18(計算值:904.10)。理論元素含量(%)C69H45NO:C,91.66;H,5.02;N,1.55;O,1.77。實測元素含量(%):C,91.57;H,4.93;N,1.43;O,1.61。上述結果證實獲得產物為目標產品。
實施例23:化合物TM22的合成
將實施例2中的溴苯替換為等摩爾的2-溴蒽,其他步驟均與實施例2相同,得到化合物TM22。質譜m/z:828.15(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.25;H,4.86;N,1.57;O,1.88。上述結果證實獲得產物為目標產品。
實施例24:化合物TM23的合成
將實施例2中的溴苯替換為等摩爾的9-溴菲,其他步驟均與實施例2相同,得到化合物TM23。質譜m/z:828.13(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.34;H,4.85;N,1.56;O,1.89。上述結果證實獲得產物為目標產品。
實施例25:化合物TM24的合成
將實施例2中的溴苯替換為等摩爾的4-溴菲,其他步驟均與實施例2相同,得到化合物TM24。質譜m/z:828.08(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.27;H,4.86;N,1.54;O,1.82。上述結果證實獲得產物為目標產品。
實施例26:化合物TM25的合成
將實施例2中的溴苯替換為等摩爾的3-溴菲,其他步驟均與實施例2相同,得到化合物TM25。質譜m/z:828.13(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.26;H,4.85;N,1.57;O,1.86。上述結果證實獲得產物為目標產品。
實施例27:化合物TM26的合成
將實施例2中的溴苯替換為等摩爾的1-溴蒽,其他步驟均與實施例2相同,得到化合物TM26。質譜m/z:828.11(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.27;H,4.86;N,1.55;O,1.81。上述結果證實獲得產物為目標產品。
實施例28:化合物TM27的合成
將實施例2中的溴苯替換為等摩爾的9-溴蒽,其他步驟均與實施例2相同,得到化合物TM27。質譜m/z:828.09(計算值:828.01)。理論元素含量(%)C63H41NO:C,91.39;H,4.99;N,1.69;O,1.93。實測元素含量(%):C,91.33;H,4.91;N,1.53;O,1.84。上述結果證實獲得產物為目標產品。
實施例29:化合物TM28的合成
將實施例2中的溴苯替換為等摩爾的1-溴芘,其他步驟均與實施例2相同,得到化合物TM28。質譜m/z:852.31(計算值:852.03)。理論元素含量(%)C65H41NO:C,91.63;H,4.85;N,1.64;O,1.88。實測元素含量(%):C,91.46;H,4.77;N,1.53;O,1.76。上述結果證實獲得產物為目標產品。
實施例30:化合物TM29的合成
將實施例2中的溴苯替換為等摩爾的2-溴苯並[9,10]菲,其他步驟均與實施例2相同,得到化合物TM29。質譜m/z:878.23(計算值:878.06)。理論元素含量(%)C67H43NO:C,91.65;H,4.94;N,1.60;O,1.82。實測元素含量(%):C,91.53;H,4.86;N,1.54;O,1.76。上述結果證實獲得產物為目標產品。
實施例31:化合物TM30的合成
將實施例2中的溴苯替換為等摩爾的1-(4’-溴-[1,1’-聯苯-3-基])萘,其他步驟均與實施例2相同,得到化合物TM30。質譜m/z:930.28(計算值:930.14)。理論元素含量(%)C71H47NO:C,91.68;H,5.09;N,1.51;O,1.72。實測元素含量(%):C,91.54;H,4.98;N,1.39;O,1.65。上述結果證實獲得產物為目標產品。
實施例32:化合物TM31的合成
將實施例2中的溴苯替換為等摩爾的9-(4-溴苯基)菲,其他步驟均與實施例2相同,得到化合物TM31。質譜m/z:904.25(計算值:904.10)。理論元素含量(%)C69H45NO:C,91.66;H,5.02;N,1.55;O,1.77。實測元素含量(%):C,91.57;H,4.96;N,1.47;O,1.67。上述結果證實獲得產物為目標產品。
實施例33:化合物TM32的合成
將實施例2中的溴苯替換為等摩爾的2-溴-9,9-二甲基芴,其他步驟均與實施例2相同,得到化合物TM32。質譜m/z:844.18(計算值:844.05)。理論元素含量(%)C64H45NO:C,91.07;H,5.37;N,1.66;O,1.90。實測元素含量(%):C,90.93;H,5.29;N,1.53;O,1.81。上述結果證實獲得產物為目標產品。
實施例34:化合物TM33的合成
將實施例2中的溴苯替換為等摩爾的2-溴-9,9'-螺二芴,其他步驟均與實施例2相同,得到化合物TM33。質譜m/z:966.23(計算值:966.17)。理論元素含量(%)C74H47NO:C,91.99;H,4.90;N,1.45;O,1.66。實測元素含量(%):C,91.86;H,4.83;N,1.37;O,1.59。上述結果證實獲得產物為目標產品。
實施例35:化合物TM34的合成
將實施例2中的溴苯替換為等摩爾的2-溴-9,9-二苯基芴,其他步驟均與實施例2相同,得到化合物TM34。質譜m/z:968.28(計算值:968.19)。理論元素含量(%)C74H49NO:C,91.80;H,5.10;N,1.45;O,1.65。實測元素含量(%):C,91.67;H,5.03;N,1.38;O,1.55。上述結果證實獲得產物為目標產品。
實施例36:化合物TM35的合成
將實施例2中的溴苯替換為等摩爾的2-溴-13,13-二甲基-13H-茚並[1,2-b]蒽,其他步驟均與實施例2相同,得到化合物TM35。質譜m/z:944.26(計算值:944.17)。理論元素含量(%)C72H49NO:C,91.59;H,5.23;N,1.48;O,1.69。實測元素含量(%):C,91.46;H,5.14;N,1.33;O,1.58。上述結果證實獲得產物為目標產品。
實施例37:化合物TM36的合成
將實施例2中的溴苯替換為等摩爾的2-溴-9,9-二己基芴,其他步驟均與實施例2相同,得到化合物TM36。質譜m/z:984.48(計算值:984.31)。理論元素含量(%)C74H65NO:C,90.30;H,6.66;N,1.42;O,1.63。實測元素含量(%):C,90.18;H,6.63;N,1.35;O,1.59。上述結果證實獲得產物為目標產品。
實施例38:化合物TM37的合成
將實施例2中的溴苯替換為等摩爾的2-溴-9,9-二辛基芴,其他步驟均與實施例2相同,得到化合物TM37。質譜m/z:1040.57(計算值:1040.42)。理論元素含量(%)C78H73NO:C,90.04;H,7.07;N,1.35;O,1.54。實測元素含量(%):C,89.91;H,6.95;N,1.27;O,1.48。上述結果證實獲得產物為目標產品。
實施例39:發光器件1的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍NPB作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。最後在陰極上蒸鍍TM5化合物作為光取出層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。該器件發藍光,發光效率為46cd/A。
實施例40:發光器件2的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍NPB作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。最後在陰極上蒸鍍TM15化合物作為光取出層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。該器件發藍光,發光效率為50cd/A。
實施例41:發光器件3的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍NPB作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。最後在陰極上蒸鍍TM22化合物作為光取出層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。該器件發藍光,發光效率為53cd/A。
實施例42:發光器件4的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍NPB作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。最後在陰極上蒸鍍TM32化合物作為光取出層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。該器件發藍光,發光效率為56cd/A。
實施例43:發光器件5的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍TM5化合物作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。最後在陰極上蒸鍍TM5化合物作為光取出層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。該器件發藍光,發光效率為60cd/A。
對比實施例:發光器件6的製備
選取ITO透明玻璃為陽極,超聲清洗後乾燥至於真空腔中,抽真空至5×10-5帕,在上述陽極基板上真空蒸鍍NPB作為空穴傳輸層,蒸鍍速率為0.1納米/秒,蒸鍍厚度為60納米。在空穴傳輸層上真空蒸鍍TCTA/FIrpic作為發光層,摻雜濃度為15wt%,蒸鍍速率為0.005納米/秒,蒸鍍厚度為30納米。在發光層上真空蒸鍍TPBI作為電子傳輸層,蒸鍍速率為0.01納米/秒,蒸鍍厚度為60納米。最後在電子傳輸層上真空蒸鍍Al層作為陰極,厚度為200納米。該器件發藍光,發光效率為30cd/A。
發光器件 | 發光效率(cd/A) |
1 | 46 |
2 | 50 |
3 | 53 |
4 | 56 |
5 | 60 |
6 | 30 |
以上結果表明,該發明的9,9-二苯基芴衍生物作為光取出層材料,套用於有機電致發光器件中,發光效率高,是性能良好的有機發光材料。
榮譽表彰
2019年10月,《一種9,9‑二苯基芴衍生物及其製備方法和套用》獲得第三屆吉林省專利獎金獎。

