專利背景
硬腦膜缺損在神經外科臨床工作中常見,工業、交通、戰爭等原因造成的開放性顱腦損傷、腫瘤的侵蝕、先天性腦膜缺損及其它顱腦疾患原因均可引發硬腦膜缺損。硬腦膜缺損需及時修補以防腦脊液外溢,防止腦的膨出和大氣壓的壓迫,否則將危及人體生命。硬腦膜缺損還能引發顱內感染、腦粘連、皮下積液等併發症,經常會引起如癲痛、頭痛、腦功能障礙等疾病。
截至2009年6月20日,硬腦膜的代用品雖有很多,修復硬腦膜的材料可分為:自體筋膜、同種異體材料、天然及人工合成材料、異種材料4類。
截至2009年6月20日,市場上現有技術產品各有其優缺點:
①自體筋膜重建硬腦膜仍然是臨床套用的標準,但術後早期腦脊液漏及皮下積液的發生率仍然較高,易導致粘連等併發症,可能引起供區不愈或功能障礙。
②同種異體和異種材料無法完全避免免疫排斥,殘留的抗原會導致不同程度的炎症反應,造成纖維變性和腦粘連。易對腦組織產生癱痕,刺激。同種異體材料來源受限,難以形成商業化生產。同時由於異體或異種來源,無法安全避免帶來病毒傳播的危險。例如來源於牛的材料的人工腦膜,因歐洲瘋牛病發生後,其來源大打折扣,而安全性也大受懷疑。
③合成的天然材料基本為天然膠原蛋白。但蛋白來源使其無法完全避免免疫排斥。行修補時所用膠原蛋白容易被吸收,無法起著充分隔離頭皮軟組織與腦組織作用而不利於之後的顱骨修補手術等問題,不利於術後處理。
④不可吸收材料/部分吸收材料的不可吸收部分對受體永遠是異物,可能導致慢性炎症反應、術區感染、延期出血,在顱腦敏感區,會產生對中樞的壓迫並引起其它併發症。
⑤不可吸收/部分吸收材料長期存在於體內,還會產生不同程度的結締組織增生包裹,更嚴重的是溶脹碎裂和植入後周圍組織愈著形成纖維性包裹,即所謂“膜片致癌”。
⑥不同的不可吸收材料還各有不足:如金屬類還不利於CT、核磁及放射檢查和治療;矽橡膠生有凝血、吸收類脂物後會溶脹碎裂,抗張強度差等問題,滌綸布類外面可形成較厚的癱痕,其下方易與腦粘連等缺點;碳纖維本身機械性能有限。
⑦已有的可吸收人工腦膜產品在降解速度、降解性能上在有一定缺陷,臨床套用範圍有限。
總之,截至2009年6月20日人工腦膜在臨床套用上都存在著不足,缺少一種具有可被完全吸收、且具有良好的柔韌性、彈性及生物組織相容性、防止腦粘連等綜合品質較高的人工腦膜產品。現有產品不利於大規模產業化生產及臨床推廣。
發明內容
專利目的
《一種具有生物活性的人工硬腦膜及其製備方法》的目的是克服人工硬腦膜產品的不足,提供一種可被完全吸收、具有良好的柔韌性、彈性及生物組織相容性、防止腦粘連、可完全降解吸收且降解速度適中、能促進硬膜化過程、不帶病毒、無免疫排斥的、可根據需要任意裁剪、製備成本較低、生產周期短、保存、運輸容易、臨床套用操作簡單、套用範圍廣泛的具有生物活性的人工硬腦膜。
《一種具有生物活性的人工硬腦膜及其製備方法》的另一目的是提供上述人工硬腦膜的製備方法。
技術方案
《一種具有生物活性的人工硬腦膜及其製備方法》通過以下技術方案實現上述目的:
一種具有生物活性的人工硬腦膜,由納米仿生支架及附著於其上的水溶膠構成,所述水溶膠內包覆有細胞因子和/或藥物。
所述人工硬腦膜至少包含相連的兩層結構,面向大腦的一層為疏水性的防粘連電紡層,背向大腦的一層為親水性的納米細胞支架層;所述面向大腦的一層和背向大腦的一層之間還可以有過渡層;任意兩個相鄰層之間的連線方式優選通過電紡連線。
所述親水性的納米細胞支架層由靜電紡製成,即背向大腦面的電紡層,為細胞支架層,是為了有效誘導幹細胞及成纖維細胞的遷入,該層則採用生物相容性好的親水性材料,再者,通過靜電紡絲參數調整,設計上控制平均孔徑達到20~100微米範圍。這樣有利於成纖維細胞的遷入、粘附、增殖和生長分化。
所述面向大腦的一層為防粘連層,採用疏水性材料,不利於細胞的遷入,從而達到防粘連的目的;《一種具有生物活性的人工硬腦膜及其製備方法》對製備該層材料的靜電紡絲參數進行調整,控制防粘連電紡層孔徑在3微米以下。材料的孔隙孔徑在納米以下,比細胞小一到二個數量級,從而阻止細胞進入,防止腦粘連產生。因為人體細胞直徑平均在10~20微米,一般成纖維細胞直徑在20~30微米之間。腦膜主要分布成纖維細胞及其分泌的膠原纖維,平均孔徑在3微米以下,已經可以有效的防止腦粘連的產生。靜電紡纖維得到的孔隙大小分布很大程度上依賴於纖維直徑,已知纖維直徑減小時,孔徑也在同時減小。據已發表的文獻,纖維直徑在4~10微米時,孔徑為20~45微米。文獻報導,靜電紡再生絲素纖維非織造織物的平均孔徑可達到2微米。
在細胞支架層和防粘連層之間還可以通過靜電紡絲技術增加過渡層。所述過渡層在細胞支架層和防粘連層之間起過渡作用,其孔徑為細胞支架層孔徑和防粘連層孔徑之間;所用材料可以是細胞支架層和防粘連層兩層材料的混合,也可以是其它材料。過渡層的孔徑可以是非均一的,從細胞支架層到防粘連層,不斷調整參數,其孔徑逐漸變小;材料也可以是非均一的,實現方法可以參照細胞支架層或防粘連層。加入過渡層,是因為細胞支架層和防粘連層所用的材料性質和孔徑相差比較大,僅管目前已有直接連線不同孔徑性能的靜電紡絲層的報導,但在實際工藝操作過程中,增加過渡層,可以使細胞支架層和防粘連層兩層接連更為自然穩固。由上述說明不難看出,過渡層並非《一種具有生物活性的人工硬腦膜及其製備方法》人工硬腦膜的一個必不可少的功能層,即使沒有過渡層《一種具有生物活性的人工硬腦膜及其製備方法》也仍然可以實施,但過渡層的加入可以從製備工藝上使得《一種具有生物活性的人工硬腦膜及其製備方法》更好地實施,因此是一個優選方案。
所述細胞因子是對成纖維細胞的粘附、遷移、增殖、分化起作用的因子,如鹼性成纖維細胞生長因子。由於人工腦膜的主要作用是在硬膜再生之前起到密封腦、防止腦脊液漏、保護腦的作用,納米仿生支架已經為成纖維細胞的粘附、遷移、增殖、分化提供了良好的支架,同時由於細胞因子的作用,可以加速硬膜化的過程。《一種具有生物活性的人工硬腦膜及其製備方法》優選的細胞因子是對硬膜化過程有促進作用的因子,如鹼性成纖維因子,鹼性成纖維細胞因子是目前公認的可以誘導成纖維細胞生長增殖並加速硬膜化過程的細胞因子,其它如:白細胞介素,集落刺激因子,TNF、血小板源生長因子等細胞因子也有文獻報導,有加速腦硬膜化過程的作用。《一種具有生物活性的人工硬腦膜及其製備方法》通過下文將述及的製備方法將這些細胞因子成功包覆於水溶膠內。
所述止血和防粘連藥物、抗感染藥物或抗腫瘤藥物的一種或藥學常規可混合使用的幾種藥物的混合物,但通過《一種具有生物活性的人工硬腦膜及其製備方法》的製備方法以及材料的選擇將這些藥物成功包覆於水溶膠內,共同構成人工腦膜的優良產品。所述藥物優選:止血因子、曲尼斯特、放線菌素D、尼莫司汀、長春新鹼、氨苄西林等。
止血藥物可以起到迅速止血,加快癒合,而防粘連藥物則可進一步減少腦粘連的產生。因為硬腦膜的修復在很多情況下是因為腦腫瘤而導致的,而腦腫瘤的復發將導致硬腦膜的再次損傷。在靜電紡電紡溶液中加入抗腫瘤藥物如放線菌素D、尼莫司汀等都可以降低腦腫瘤的復發率。在因腦腫瘤而導致的硬腦膜修復手術中,加入這類藥物可大大降低腦腫瘤的復發率。抗感染藥物可選自抗生素,如氨苄西林,螺旋黴素,磺胺,喹諾酮類抗生素等可防止細菌感染,在臨床上可降低腦膜移植的感染率。
《一種具有生物活性的人工硬腦膜及其製備方法》的人工硬腦膜的製備是通過靜電紡製得納米仿生支架、利用生物列印技術將水溶膠溶液列印到所述納米仿生支架、水溶膠固化後即得人工硬腦膜。所述生物列印技術是近年來出現的新技術。生物列印能按預定計畫精確定位,這和列印技術的特點是一致的。生物列印與一般列印的不同僅在於其墨水和接受列印的紙張不一樣。生物列印的紙片是在體內可降解的生物紙片;生物列印的“生物墨水”是特製的細胞溶液或有生物活性的細胞因子溶液。生物列印技術是將這種特製溶液噴射到可生物降解的生物紙片上。列印後再將紙片按一定順序的堆疊。由於使用了列印技術,可以將細胞或/和細胞因子組成的生物墨水精確的結合到預定部位;而按特定的堆疊方式的生物紙片則會形成三維結構。理論上如果所用的生物墨水是細胞溶液,則形成三維的組織結構和器官,最後生物紙片降解,細胞保留下來,形成立體結構,例如,活的三維組織、血管和器官。但是生物列印技術仍處於基礎研究的階段,相關文獻也集中於理論探討層面,還沒有出現直接利用細胞通過生物列印技術製備人工器官的具體技術方案,也沒有任何採用生物列印技術成功製備人工硬腦膜的相關報導。《一種具有生物活性的人工硬腦膜及其製備方法》基於上述理論,通過大量實驗總結得到生物墨水的具體組成、生物紙片的具體組成和製備方法、三維結構的最終實現方案,從而解決了通過生物列印方法製備人工硬腦膜的技術難題。
《一種具有生物活性的人工硬腦膜及其製備方法》利用生物列印技術製備人工硬腦膜的方法包括以下步驟:
(1)製備電紡溶液、含有細胞因子和/或藥物的水溶膠溶液和交聯劑溶液;
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架;所述納米紡生支架紡成至少兩層結構,面向大腦的一層紡成疏水性的防粘連層,背向大腦的一層紡成親水性的細胞支架層;
(3)用噴墨印表機將含有細胞因子和/或藥物的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得人工硬腦膜。
上述方法中,步驟(2)和(3)可重複一次或者更多次,以得到不同厚度的硬腦膜。
所述“製備含有細胞因子和/或藥物的水溶膠溶液”也可以在步驟(2)和步驟(3)之間進行,不影響《一種具有生物活性的人工硬腦膜及其製備方法》的實現。
所述水溶膠溶液中加入細胞因子和/或藥物;所述細胞因子或藥物同前所述。
所述水溶膠可以是以下聚合物製成的水溶膠:多糖類聚合物,如澱粉、纖維素、海藻酸、透明質酸或殼聚糖;多肽類聚合物,如膠原、聚L~賴氨酸或聚L~谷胺酸;合成的親水高分子聚合物,如聚丙烯酸、聚甲基丙烯酸、聚丙烯醯胺或聚N~聚代丙烯醯胺。上述聚合物製備的水溶膠通過改變溫度、酸鹼度、經紫外線照射或者加入交聯劑(固化液)等方法,可由液態轉變為固態。
所述電紡溶液是一種或兩種以上聚合物混合的電紡溶液,親水性聚合物材料選自硫酸軟骨素,肝素,瓊脂,葡聚糖、褐藻酸、改性纖維素、海藻酸、澱粉、纖維素、明膠、纖維蛋白、絲蛋白、彈力蛋白擬態的肽聚合物、膠原蛋白、殼聚糖、改性殼聚糖、親水性聚氨酯、聚乙二醇、聚甲基丙烯酸甲酯、聚甲基丙烯酸甲酯、聚羥基丁酸戊酸酯、聚羥基丁酸己酸酯、聚乙烯醇或聚丙交酯;疏水性聚合物材料選自疏水性聚氨酯、聚碳酸酯、聚乳酸、聚己內酯、聚乙交酯或聚對苯二甲酸乙二酯。由於目前高分子材料改性研究在不斷發展,原本親水性材料改性為疏水或疏水材料改性為親水都越來越常見,範圍也越來越廣。
將上述材料溶於一定的溶劑,形成電紡液,就可以通過靜電紡絲技術製得納米仿生支架。
上述電紡溶液的溶劑可以為甲酸、乙酸、乙醇、丙酮、二甲基甲醯胺、二甲基乙醯胺、四氫呋喃、二甲基亞碸、六氟異丙醇、三氟乙醇、二氯甲烷、三氯甲烷、甲醇、乙醇、氯仿、二噁烷、三氟乙烷、三氟乙酸、水或它們的任意混合物。上述的高分子材料和溶劑用於靜電紡絲的相關技術,例如材料與溶劑的重量比例等參照現有(截至2009年6月20日)技術。
所述防粘連層的靜電紡的優選工藝參數為:
微量注射泵的速率為0.1~5.0毫升/小時,高壓發生器的電壓為5~40千伏,接收距離為5.0~30.0厘米。細胞支架層的靜電紡的工藝參數為:0.5~20.0毫升/小時,調節高壓發生器的電壓為10~45千伏,調節接收裝置的接收距離為5.0~30.0厘米。此處通過靜電紡製備得到纖維直徑平均孔徑在3微米或以下,纖維直徑在50~1000納米之間。
所述疏水性的電紡溶液可選擇疏水性的L~聚乳酸和ε~己內酯,兩者重量比為50∶50或30∶70或70∶30,作為共聚高分子材料,數均分子量是150000~500000,溶於六氟異丙醇或二氯甲烷;可用溶液總重量百分比8~14%的聚己內酯的氯仿/甲醇混合溶液;或者其他合適的聚合物及溶劑。
疏水性電紡支架層作為“生物紙片”,可在其上列印止血和防粘連藥物、抗感染藥物及抗腫瘤藥物,也可用混紡紡入,具體的混紡方法可以參考現有(截至截至2009年6月20日)技術的相關內容。
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為0.1~10毫升/小時,調節高壓發生器的電壓為10~45千伏,調節接收裝置的接收距離為10~40厘米,並將纖維接收為膜狀結構。
此處通過靜電紡製備得到纖維直徑平均孔徑在3微米或以下。纖維直徑在50~1000納米之間。
所述親水性的電紡溶液選擇的親水性材料作製備細胞支架層,可以選用親水性聚氨酯或者天然明膠、纖維素、殼聚糖、硫酸軟骨素等親水性材料;優選的方案:親水性聚氨酯,與/或天然明膠,硫酸軟骨素、聚乙二醇,重量比20~80∶80~20,紡絲液為溶液總重量的3~15%;或者用親水性聚氨酯與天然明膠,或硫酸軟骨素,重量比20~80∶80~20,紡絲液為溶液總重量的3~15%;也可選用其他合適聚合物及溶劑,親水性的納米細胞支架層孔徑為20~200微米。納米細胞支架層纖維直徑介於5~200微米。
以親水性納米支架層作為生物紙片,可以在其上列印細胞因子,止血藥物、防粘連藥物、抗感染藥物或抗腫瘤藥物。
所述親水性電紡支架層的靜電紡絲參數如下:接收距離從15~25厘米,電壓15~45千伏,纖維平均直徑在500~10000納米開啟靜電紡絲,在已紡好的防粘連層上繼續紡細胞支架層。
所述電紡溶液中添加藥物或因子的優選方案是:含有溶液質量百分比濃度為0.001~0.05%的鹼性成纖維細胞成長因子,溶液質量百分比濃度為3%的苄氨西林,溶液質量百分比濃度為0.001~0.05%的止血因子,在用於因腦腫瘤而導致的腦膜修復手術中,可以包含有0.01~5%的尼莫司汀。
所述過渡層溶液中的靜電紡絲參數如下:接收距離從10~30厘米,電壓10~45千伏,開啟靜電紡絲,在已紡好的防粘連層上繼續紡過渡層,在過渡層上繼續紡細胞支架層。
過渡層可以添加藥物或因子,也可以不添加。
因為過渡層所採用的工藝參數是在細胞支架層和防粘連層之間,所以,由於過渡層的連線,可能使製備的防粘連層和細胞支架層之間的接連有緩衝區,孔徑和材料變化不至於過於突兀,從而影響人工腦膜產品的套用效果。
優選方案為:聚氨酯與透明質酸的質量比為70∶30,紡絲液質量分數為10%。纖維平均直徑在500~20000納米。
上述用生物列印製備所述雙層人工腦膜更具體的步驟是:
1、製備防粘連層:製備防粘連層的電紡溶液、含有藥物或止血因子的水溶膠溶液和交聯劑溶液;
(1)將配置好的0.1M交聯劑溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機進行改裝,例如可參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印。
(2)用所述交聯劑溶液接收靜電紡絲製得防粘連層的納米仿生支架;所用靜電紡絲參數為前述的防粘連層靜電紡參數。
(3)用噴墨印表機將含有止血因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
步驟(2)、(3)可以重複,直到得到適合厚度的防粘連層。關閉靜電紡絲和列印。調整靜電紡絲和列印的材料和參數。
2、製備細胞支架層:製備細胞支架層的電紡溶液、含有細胞因子的水溶膠溶液;
(1)在紡好的防粘連層上,繼續接收靜電紡絲,製得細胞支架層的納米仿生支架,所製得的細胞支架層仍浸於前述的交聯劑溶液中;這裡所採用的靜電紡絲參數是細胞支架層的電紡參數,電紡參數同上。
(2)用噴墨印表機將含有鹼性成纖維細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
(1)、(2)可重複以得到合適的厚度。
製得的產品經清洗、滅菌,包裝後貯存,《一種具有生物活性的人工硬腦膜及其製備方法》人工硬腦膜保存、運輸容易。
改善效果
(一)《一種具有生物活性的人工硬腦膜及其製備方法》提供了一種新的修復硬腦膜的材料,解決了現有(截至2009年6月20日)產品易發生腦粘連、易帶病毒、易產生免疫排斥等缺陷,《一種具有生物活性的人工硬腦膜及其製備方法》硬腦膜具有以下優點:
1、機械特性能滿足適應症對抗拉伸強度及柔韌性的要求。
2、雙層設計,內側面(即面向大腦的一面)光滑,能防粘連,能起著很好地隔離頭皮軟組織與腦組織的作用,外側面(即背向大腦的一面)和側邊則為多孔結構,允許細胞長入;可促使儘早自體成纖維細胞以及某些未分化的細胞向膠原內部沁潤生長浸潤,促使腦膜早日修復。利於日後進行顱骨修復手術。
3、能夠在新生組織生成後被完全吸收的,避免了膜片致癌。
4、不含活細胞成分,不使用外源細胞和蛋白,免除了因此而帶來免疫排斥、病毒傳播、疾病傳染的諸多風險;能杜絕疾病傳播。
5、使用的材料是目前已經證實對人體無毒無害的安全生物材料,具有良好的生物組織相容性,無異物排斥反應,無毒性反應,無致癌、致畸作用。不會帶來免疫排斥、病毒傳播、疾病傳染的諸多風險,也不會帶來其它毒害作用;
6、人工腦膜材料來源充分,成本較低,避免了天然材料來源不足,成本高,改性複雜的缺點,貯存運輸簡單。
7、人工腦膜的製備方法工藝步驟簡化,生產時間短,能有效避免加工過程中產品受到污染,產品質量易於控制,產品標準容易實現,產品可實現低成本、高效率的產業化生產。
8、根據《一種具有生物活性的人工硬腦膜及其製備方法》製備的人工腦膜臨床套用簡單,由於在處理中沒有引入戊二醛等毒性物質,在臨床套用時不需要再進行嚴格的浸泡和清洗,也因此避免了由於提前浸泡造成的預選尺寸不夠而使產品報廢的情況。
(二)《一種具有生物活性的人工硬腦膜及其製備方法》成功利用生物列印技術將鹼性成纖維細胞生長因子、血小板源生長因子等細胞因子按設計要求,精確結合於納米支架上。採用生物列印技術結合納米支架,可以達到細胞因子有效按所的濃度和精確位點結合,可以同時結合多種不同濃度、不同分布的不同細胞因子,納米支架同時作為細胞因子緩釋控制體系,細胞因子可控釋放。這樣可以最大限度模擬體內生理環境,形成有利於成細胞遷移、聚集、分化的微環境,吸引成纖維細胞進入硬腦膜缺損部位,並聚集、分化,加速了硬膜化過程;與沒有加入細胞因子的人工腦膜相比,或者與單純用混紡技術加入細胞因子的人工腦膜相比,其過程大為縮短。因此,可在臨床上加速創傷癒合,縮短病程,減輕病人痛苦。
(三)《一種具有生物活性的人工硬腦膜及其製備方法》用生物列印將藥物加入了人工腦膜,比單純利用靜電紡絲技術的人工腦膜相比,可有效防止感染、防粘連、防腦腫瘤復發。此種效應與沒有加入藥物的人工腦膜相比,其感染率大為降低,腦粘連發生率和腦腫瘤復發率大為降低。而且,由於用生物列印技術可以精確定位,加入的藥物的量可以按需要調節,比如急性感染期濃度更高(即人工腦膜表面),慢性感染期(即人工腦膜里)濃度低,這不僅減輕了藥物的用量,更重要的是,在顱腦敏感區降低藥物用量之後,減少了隨之而來的藥物不良反應。
附圖說明
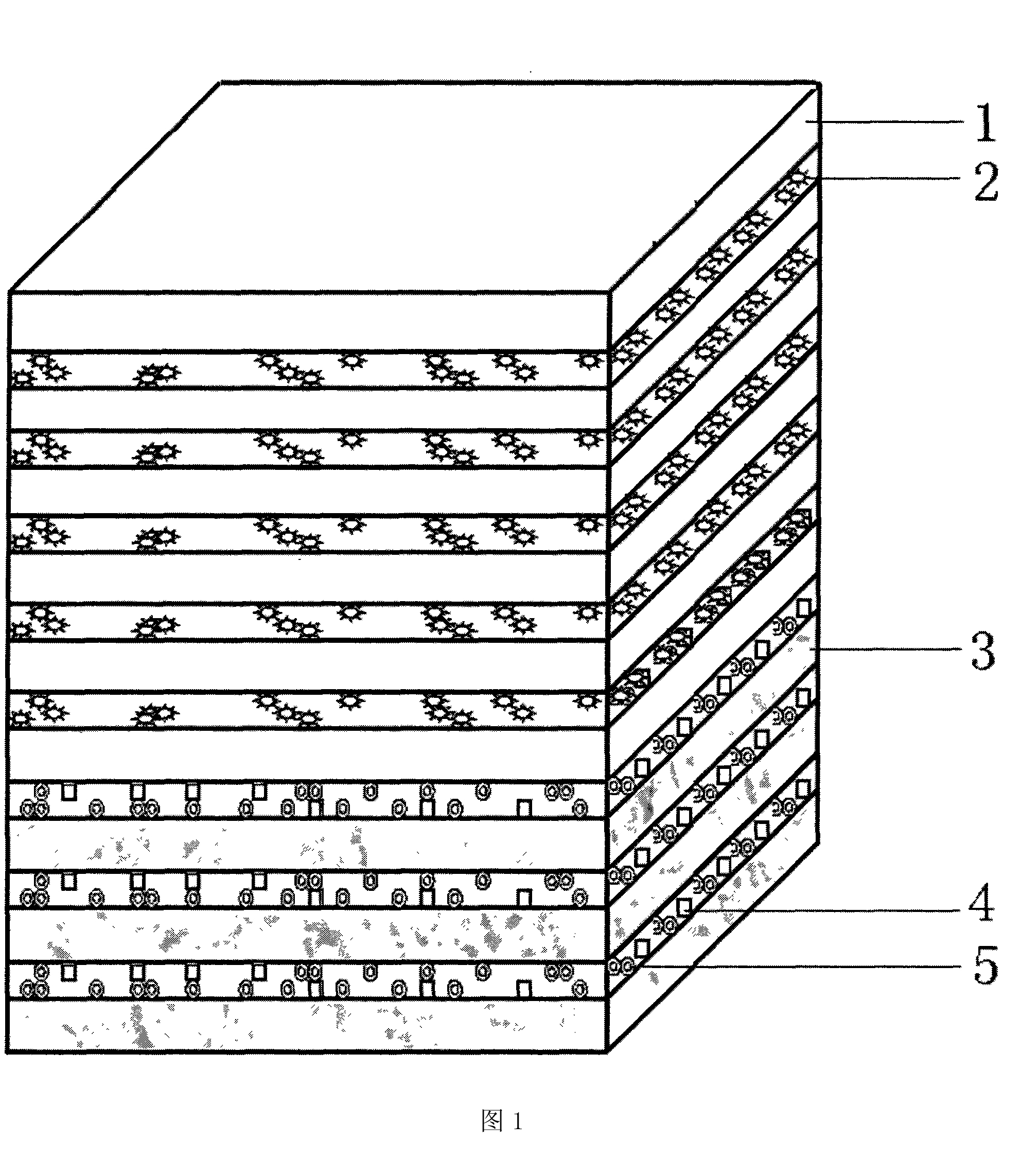
圖1實施例1製得的人工腦膜結構示意圖,1為細胞支架層,2為鹼性成纖維細胞因子,3為防粘連層,4為抗生素,5為止血和防粘連藥物。
技術領域
《一種具有生物活性的人工硬腦膜及其製備方法》涉及一種具有生物活性的人工硬腦膜及其製備方法,屬於生物醫學技術領域。
權利要求
1.一種具有生物活性的人工硬腦膜,其特徵是由納米仿生支架及附著於其上的水溶膠構成,所述水溶膠內包覆有細胞因子和/或藥物;所述納米仿生支架至少包含相連的兩層結構,面向大腦的結構層為疏水性的防粘連電紡層,背向大腦的結構層為親水性的納米細胞支架層。
2.如權利要求1所述的人工硬腦膜,其特徵在於所述防粘連電紡層和納米細胞支架層之間還有過渡層。
3.如權利要求2所述的人工硬腦膜,其特徵在於納米細胞支架層孔徑為20~200微米;防粘連電紡層孔徑在3微米以下;所述過渡層孔徑在納米細胞支架層孔徑和防粘連電紡層孔徑之間。
4.如權利要求1或2或3所述的人工硬腦膜,其特徵在於所述細胞因子是對硬膜化過程有促進作用的細胞因子;所述藥物是止血藥物、防粘連藥物、抗感染藥物或抗腫瘤藥物的一種或藥學常規可混合使用的幾種藥物的混合物。
5.如權利要求4所述的納米仿生人工硬腦膜,其特徵在於所述對硬膜化過程有促進作用的細胞因子選自白細胞介素、集落刺激因子、腫瘤壞死因子、血小板源生長因子或鹼性成纖維細胞因子的一種或幾種。
6.如權利要求1或2或3所述的人工硬腦膜,其特徵在於所述電紡層或支架層均是採用支架材料通過靜電紡絲技術製備得到,所述支架材料為聚乳酸、聚已內酯、聚乙交酯、聚氨酯、聚乙二醇、聚對苯二甲酸乙二酯、聚甲基丙烯酸甲酯、聚羥基丁酸戊酸酯、聚羥基丁酸己酸酯、聚磷酸酯、聚氨基甲酸酣、聚L~乳酸、聚酯醯胺、聚乙烯醇、聚丙交酯、聚氧乙烷、聚對二惡酮、丙交酯、乙交酯、丁內酯、戊內酯、己內酯、環氧乙烷、環氧丙烷、聚氨酯類、聚碳酸酯、膠原蛋白、明膠、殼聚糖、改性殼聚糖、澱粉、纖維素、改性纖維素、纖維蛋白、絲蛋白、彈力蛋白擬態的肽聚合物、海藻酸、硫酸軟骨素、肝素、瓊脂、葡聚糖或褐藻酸的任意一種或兩種以上材料的混合物。
7.一種權利要求1或2或3所述人工硬腦膜的製備方法,其特徵在於包括如下步驟:(1)製備電紡溶液、含有細胞因子和/或藥物的水溶膠溶液和交聯劑溶液;(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架;所述納米紡生支架紡成至少兩層結構,面向大腦的一層紡成疏水性的防粘連層,背向大腦的一層紡成親水性的細胞支架層;(3)用噴墨印表機將含有細胞因子和/或藥物的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
8.一種權利要求1或2或3所述人工硬腦膜的製備方法,其特徵在於包括如下步驟:(1)製備電紡溶液和交聯劑溶液;(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架;所述納米紡生支架紡成至少兩層結構,面向大腦的一層紡成疏水性的防粘連層,背向大腦的一層紡成親水性的細胞支架層;製備含有細胞因子和/或藥物的水溶膠溶液;(3)用噴墨印表機將含有細胞因子和/或藥物的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
9.如權利要求7或8所述的製備方法,其特徵在於步驟(2)和(3)重複若干次。
10.如權利要求9所述的製備方法,其特徵在於所述水溶膠是以多糖類聚合物、多肽類聚合物或合成的親水高分子聚合物製成的水溶膠;所述多糖類聚合物為澱粉、纖維素、海藻酸、透明質酸或殼聚糖;所述多肽類聚合物為膠原、聚L~賴氨酸或聚L~谷胺酸;所述合成的親水高分子聚合物為聚丙烯酸、聚甲基丙烯酸、聚丙烯醯胺或聚N~聚代丙烯醯胺;所述電紡溶液的溶劑為甲酸、乙酸、乙醇、丙酮、二甲基甲醯胺、二甲基乙醯胺、四氫呋喃、二甲基亞碸、六氟異丙醇、三氟乙醇、二氯甲烷、三氯甲烷、甲醇、氯仿、二噁烷、三氟乙烷、三氟乙酸或水的任意一種或者它們任意比例的混合物。
實施方式
1.製備電紡溶液、含有藥物的水溶膠溶液和交聯劑溶液:
(1)電紡液選擇疏水性的L-聚乳酸和ε-己內酯,兩者比值為50∶50,作為共聚高分子材料,數均分子量是260000,溶於六氟異丙醇。
交聯劑溶液選用0.1M氯化鈣溶液。
含有細胞因子的水溶膠溶液採用止血因子藻酸鹽溶液,所述細胞因子藻酸鹽溶液中止血因子的質量百分比濃度為10ppm。
將配置好的0.1M氯化鈣溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機按照現有專利報導進行改裝,參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印;將配好的細胞因子藻酸鹽溶液裝入噴墨列印墨盒中;本實施例採用的墨盒型號為HP51626A。
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架:
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為5毫升/小時,調節高壓發生器的電壓為30千伏,調節接收裝置的接收距離為20厘米,用並將纖維接收為膜狀結構。靜電紡絲20分鐘,關閉靜電紡絲。
(3)用噴墨印表機將含有細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
紡絲和列印重複5次,製得防粘連層厚度約0.2毫米。
此處通過靜電紡製備得到纖維直徑平均300納米。
2、製備細胞支架層
製備電紡溶液、含有藥物的水溶膠溶液和交聯劑溶液;
採用親水性材料,聚乙二醇與硫酸軟骨素質量比為70∶30,紡絲液質量分數為9%,交聯劑溶液選用0.1M氯化鈣溶液。
含有細胞因子的水溶膠溶液採用鹼性成纖維細胞因子的藻酸鹽溶液,所述細胞因子藻酸鹽溶液中鹼性成纖維因子的質量百分比濃度為100ppm。
(1)將配置好的0.1M氯化鈣溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機按照現有專利報導進行改裝,例如可參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印。將配好的細胞因子藻酸鹽溶液裝入噴墨列印墨盒中。本實施例採用的墨盒型號為HP51626A。
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架;
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為0.8毫升/小時,調節高壓發生器的電壓為20千伏,調節接收裝置的接收距離為11厘米,用並將纖維接收為膜狀結構。靜電紡絲20分鐘,關閉靜電紡絲。
(3)用噴墨印表機將含有鹼性成纖維細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。製得的人工腦膜見圖1所示,1為細胞支架層,2為鹼性成纖維細胞因子,3為防粘連層,4為抗生素,5為止血和防粘連藥物。
紡絲和列印重複10次,製得防粘連層厚度約0.4毫米
纖維平均直徑在10微米
3、清洗,滅菌,包裝。
1、製備防粘連層
(1)製備電紡溶液、含有藥物的水溶膠溶液和交聯劑溶液:
電紡液選擇疏水性的L-聚乳酸和ε-己內酯,兩者比值為50∶50,作為共聚高分子材料,數均分子量是260000,溶於六氟異丙醇。
交聯劑溶液選用0.1M氯化鈣溶液。
含有細胞因子的水溶膠溶液採用止血因子藻酸鹽溶液,所述細胞因子藻酸鹽溶液中止血因子的質量百分比濃度為10ppm。
將配置好的0.1M氯化鈣溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機按照現有專利報導進行改裝,參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印;將配好的細胞因子藻酸鹽溶液裝入噴墨列印墨盒中;本實施例採用的墨盒型號為HP51626A。
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架:
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為5毫升/小時,調節高壓發生器的電壓為30千伏,調節接收裝置的接收距離為20厘米,用並將纖維接收為膜狀結構。靜電紡絲20分鐘,關閉靜電紡絲。
(3)用噴墨印表機將含有細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
紡絲和列印重複5次,製得防粘連層厚度約0.2毫米。
此處通過靜電紡製備得到纖維直徑平均300納米。
2、製備過渡層:
(1)製備電紡溶液、含有藥物的水溶膠溶液和交聯劑溶液:
電紡液選擇以下方案:聚氨酯與透明質酸的質量比為70∶30,紡絲液質量分數為10%。混合氨苄西林,濃度為3%。得到均一溶液。
交聯劑溶液選用0.1M氯化鈣溶液。
含有細胞因子的水溶膠溶液採用止血因子藻酸鹽溶液,所述細胞因子藻酸鹽溶液中止血因子的質量百分比濃度為10ppm。
將配置好的0.1M氯化鈣溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機按照現有專利報導進行改裝,參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印;將配好的細胞因子藻酸鹽溶液裝入噴墨列印墨盒中;本實施例採用的墨盒型號為HP51626A。
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架:
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為4毫升/小時,調節高壓發生器的電壓為20千伏,調節接收裝置的接收距離為11厘米,用並將纖維接收為膜狀結構。靜電紡絲20分鐘,關閉靜電紡絲。
(3)用噴墨印表機將含有細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
紡絲和列印重複3次,製得防粘連層厚度約0.1毫米。
纖維平均直徑在5微米。
3、製備細胞支架層
製備電紡溶液、含有藥物的水溶膠溶液和交聯劑溶液;
採用親水性材料,聚乙二醇與硫酸軟骨素質量比為70∶30,紡絲液質量分數為9%,交聯劑溶液選用0.1M氯化鈣溶液。
含有細胞因子的水溶膠溶液採用鹼性成纖維細胞因子的藻酸鹽溶液,所述細胞因子藻酸鹽溶液中鹼性成纖維因子的質量百分比濃度為100ppm。
(1)將配置好的0.1M氯化鈣溶液放入直徑150毫米的細胞培養皿中,置於靜電紡絲裝置及印表機共用的平板接收器上。將惠普550C噴墨印表機按照現有專利報導進行改裝,例如可參照美國專利US7051654公開的方法,固定在電紡絲裝置箱內電紡針頭正下方,用作止血因子定位列印。將配好的細胞因子藻酸鹽溶液裝入噴墨列印墨盒中。本實施例採用的墨盒型號為HP51626A。
(2)用所述交聯劑溶液接收靜電紡絲製得納米仿生支架;
將上述溶液加入靜電紡裝置的注射器中,調節微量注射泵的速率為0.8毫升/小時,調節高壓發生器的電壓為20千伏,調節接收裝置的接收距離為11厘米,用並將纖維接收為膜狀結構。靜電紡絲20分鐘,關閉靜電紡絲。
(3)用噴墨印表機將含有鹼性成纖維細胞因子的水溶膠溶液列印到所述納米仿生支架上,水溶膠固化後即得。
紡絲和列印重複15次,製得防粘連層厚度約0.3毫米。
纖維平均直徑在10微米。
3、清洗,滅菌,包裝。
用實施例1製得的硬腦膜進行犬動物實驗:
實驗犬體重15~20千克,年齡1.5~2歲,雌雄不拘,共5隻。以氯胺酮肌肉注射全麻,麻醉剃毛後,將動物置於專用手術台上,腹臥位。用2%碘酒和75%酒精消毒。動物頭頂正中,縱向切開。用剝離器分離骨膜,暴露雙頂部顱骨板,用高速磨鑽磨開顱骨,雙頂部形成骨窗。用小剪刀剪掉雙側頂部3厘米×3厘米大小的矩形硬腦膜,製造出頂部的硬腦膜缺損。在暴露的腦表面電灼,造成6個1毫米×1毫米大小的損傷點。將用《一種具有生物活性的人工硬腦膜及其製備方法》實施例1所製備的人工腦膜修剪成相應形狀及尺寸的修補材料,防粘連層向腦表面,用4/0無損傷絲線間斷縫合,針距4毫米,修補於犬頂部的缺損。用圓針4號絲線縫合肌肉。術後對動物進行常規的餵養及觀察。術後動物恢復良好,切口癒合良好,無腦脊液漏,無癲癇發生。術後進食進水正常,動物的戶外活動正常,沒有發現運動障礙,存活至預定期限。
術後12個月,動物以手術部位為中心,在大於手術部位1厘米範圍切取標本,使其包括人工腦膜及周邊硬腦膜及內面的腦組織。切取出標本後,可見人工腦膜與硬腦膜的連線處對合平整,無分界,已完全癒合,僅見縫合的絲線。原生硬腦膜之間未見明顯充血,出血等排異反應。
用實施例2製得的硬腦膜進行紐西蘭兔動物實驗:
實驗的動物施行頂部開顱,人為製造部分硬腦膜缺損及腦組織損傷,然後以人工腦膜分別實施硬腦膜修補術。術後對動物進行常規的餵養及觀察。術後動物恢復良好。術後12個月,動物以手術部位為中心,在大於手術部位1厘米範圍切取標本,使其包括人工腦膜及周邊硬腦膜及內面的腦組織。切取出標本後,可見內側表面可見上皮細胞覆蓋,上皮下可見纖維組織增生,纖維母細胞增生,膠原纖維增多,致使材料內帶血運的新生組織增生,宿主新生組織侵入,材料降解,總量明顯減少,內部可見毛細血管。新老組織界面無中性粒細胞,淋巴細胞等炎症細胞反應,界面處無囊壁形成。蛛網膜及腦組織正常。
榮譽表彰
2018年12月20日,《一種具有生物活性的人工硬腦膜及其製備方法》獲得第二十屆中國專利獎優秀獎。